وقتی ورزش به جنگ سرطان میرود؛ مکانیسم شگفتانگیزی که خطر تومور را کاهش میدهد

وقتی ورزش به جنگ سرطان میرود؛ چگونه فعالیت بدنی تومورها را گرسنه میکند؟
پارادایم نوین در پیشگیری و درمان سرطان
سرطان، همچنان یکی از چالشبرانگیزترین معضلات سلامت جهانی در قرن بیست و یکم باقی مانده است. با وجود پیشرفتهای چشمگیر در حوزههای تشخیص زودرس و درمانهای هدفمند مولکولی، نرخ بروز جهانی این بیماری روندی صعودی را نشان میدهد. در این میان، تمرکز تحقیقات از رویکردهای صرفاً درمانی به سمت استراتژیهای قدرتمند پیشگیری تغییر یافته است. در صدر این استراتژیها، فعالیت بدنی منظم قرار دارد؛ عاملی که نه تنها خطر ابتلا به چندین نوع سرطان را کاهش میدهد، بلکه میتواند بر پیشرفت بیماری در بیماران تشخیص داده شده نیز تأثیر مثبت بگذارد.
ورزش، فراتر از یک توصیه عمومی برای حفظ تناسب اندام، اکنون به عنوان یک تعدیلکننده قوی بیولوژیکی در نظر گرفته میشود که میتواند مسیرهای متابولیک و سیگنالینگ سلولی حیاتی برای بقا و تکثیر سلولهای سرطانی را مختل سازد. این مقاله تحقیقی-تحلیلی با هدف روشن ساختن مکانیسمهای زیستی و مولکولی دقیق این پدیده، با الهام از آخرین دستاوردهای علمی منتشر شده در محافل معتبر، به بررسی این موضوع میپردازد که چگونه فعالیت بدنی میتواند تومورها را «گرسنه» نگه دارد و رشد آنها را مهار نماید. ما مسیرهای کلیدی مانند سیگنالینگ گلوکز، نقش حیاتی کینازهای AMPK و mTOR، و تأثیر ورزش بر رونویسی ژنهای مرتبط با سرطان را تشریح خواهیم کرد.
۱.۱. ورزش به مثابه داروی ضد سرطان (Chemoprevention)
در دهههای اخیر، شواهد اپیدمیولوژیک به طور مداوم ارتباط قوی بین سطح بالای فعالیت بدنی و کاهش خطر ابتلا به سرطانهای روده بزرگ، پستان، آندومتر و پروستات را تأیید کردهاند. اما سؤال اصلی این است: این تأثیر محافظتی چگونه در سطح سلولی و مولکولی اعمال میشود؟ پاسخ در تعامل پیچیده بین محیط متابولیک بدن و تومور نهفته است. سلولهای سرطانی دارای ویژگی متابولیکی به نام «اثر واربرگ» (Warburg Effect) هستند؛ آنها برای تأمین انرژی و مواد اولیه ساختاری، شدیداً وابسته به تخمیر گلوکز (گلیکولیز هوازی) میباشند، حتی در حضور اکسیژن کافی. ورزش با تغییرات عمدهای در دینامیک منابع انرژی بدن، این وابستگی حیاتی را به چالش میکشد.
۱.۲. چارچوب تحلیلی Golden‑Health Insight 2025
رویکرد ما در این تحلیل، ادغام دادههای گسترده اپیدمیولوژیک با یافتههای ریزمقیاس بیولوژی مولکولی است. ما تمرکز ویژهای بر مطالعات پیشرفتهای خواهیم داشت که توانستهاند تأثیر ورزش را در سطح بیان ژنی و تنظیم پروتئینها در مدلهای حیوانی، و سپس امکان تعمیم آنها به فیزیولوژی انسان را مورد ارزیابی قرار دهند. در این چارچوب، ورزش به عنوان یک عامل تعدیلکننده محیط تومور (Tumor Microenvironment Modulator) در نظر گرفته میشود.
مرور اپیدمیولوژی سرطان و ورزش: شواهد جهانی
تأثیر محافظتی ورزش بر سرطان یک مشاهده جدید نیست، اما درک مکانیسمهای زیربنایی آن نیازمند تحلیلهای جامعتری است که فراتر از مشاهدات رفتاری باشد. آمار جهانی نشان میدهد که افزایش بیست درصدی در سطح فعالیت بدنی میتواند منجر به کاهش قابل توجهی در بار کلی سرطان شود.
۲.۱. کاهش خطر در سرطانهای اصلی
مطالعات بزرگ جمعیتی (Cohort Studies) به طور مداوم ارتباط معکوس بین ورزش و سرطانهای وابسته به هورمون و متابولیسم را تأیید کردهاند:
- سرطان پستان: فعالیت بدنی نه تنها خطر ابتلا به سرطان پستان پیش از یائسگی و پس از یائسگی را کاهش میدهد، بلکه در بازماندگان سرطان پستان نیز به کاهش عود و بهبود بقا کمک میکند. این اثر اغلب به تنظیم سطح هورمونهای استروژن و انسولین نسبت داده میشود.
- سرطان روده بزرگ (کولورکتال): این سرطان یکی از قویترین ارتباطات را با ورزش نشان میدهد. مکانیسمهای کلیدی شامل کاهش زمان عبور روده، کاهش مواجهه با مواد سرطانزا، و بهبود پاسخهای ایمنی است.
- سرطانهای مرتبط با چاقی (آندومتر، کلیه): از آنجا که ورزش یکی از مؤثرترین ابزارها برای کنترل وزن و کاهش چربی احشایی است، تأثیر آن بر سرطانهایی که مستقیماً با چاقی و التهاب مزمن مرتبط هستند، بسیار پررنگ است.
۲.۲. مکانیسمهای کلان محافظتی
پیش از ورود به جزئیات مولکولی، لازم است به تأثیرات سیستمی ورزش اشاره کنیم که بستری برای مهار تومور فراهم میسازند:
۲.۲.۱. کاهش التهاب مزمن (Chronic Inflammation)
التهاب مزمن یک عامل کلیدی در تومورزایی (Carcinogenesis) است. ورزش منظم باعث کاهش نشانگرهای التهابی سیستمیک مانند پروتئین واکنشدهنده C (CRP)، اینترلوکین ۶ (IL-6) و TNF-آلفا میشود. این کاهش التهاب، محیطی نامساعد برای شروع و پیشرفت سرطان ایجاد میکند.
۲.۲.۲. بهبود عملکرد سیستم ایمنی (Immunosurveillance)
فعالیت بدنی به طور مستقیم بر عملکرد سلولهای کشنده طبیعی (NK Cells) و سلولهای T سیتوتوکسیک تأثیر میگذارد. این سلولها خط مقدم دفاعی بدن در برابر سلولهای جهشیافته هستند. ورزش باعث افزایش گردش این سلولها در خون و بهبود توانایی آنها در شناسایی و کشتن سلولهای پیشسرطانی میگردد.
۲.۲.۳. تعدیل محور انسولین/IGF-1
سطوح بالای انسولین و فاکتور رشد شبه انسولین-۱ (IGF-1) به عنوان محرکهای رشد سلولی عمل میکنند و میتوانند پرولیفراسیون سلولهای سرطانی را تقویت کنند. ورزش با افزایش حساسیت به انسولین و کاهش سطح گلوکز و انسولین سرمی، این مسیرهای محرک رشد را تضعیف میکند.
توضیح متابولیسم انرژی: نبرد میان mTOR و AMPK
قلب مکانیسم اثر ورزش بر تومور، دستکاری در دینامیک انرژی سلولی است. سلولهای سرطانی، به ویژه آنهایی که ویژگی واربرگ را دارند، در یک محیط پر از مواد مغذی (بستری که اغلب ورزش آن را تغییر میدهد) شکوفا میشوند. ورزش به طور چشمگیری این محیط را به چالش میکشد و دو مسیر سیگنالینگ اصلی سلولی را به نفع بدن فعال میسازد.
۳.۱. مسیر سیگنالینگ mTOR: موتور رشد سلولی
مسیر پروتئین کیناز فعال شده توسط میتوز (mTOR) یک مسیر مرکزی تنظیمکننده رشد، تکثیر، سنتز پروتئین و متابولیسم سلولی است. mTOR به عنوان یک حسگر وضعیت مواد مغذی و انرژی عمل میکند. وقتی سطح انرژی سلول بالا باشد (ATP فراوان باشد) و اسیدهای آمینه کافی در دسترس باشند، mTOR فعال میشود و به سلول دستور رشد و تقسیم میدهد.
[ \text{ATP} \uparrow, \text{Amino Acids} \uparrow \rightarrow \text{mTOR} \text{ Activation} \rightarrow \text{Cell Growth and Proliferation} ]
سلولهای سرطانی اغلب دارای یک mTOR بیشفعال هستند که آنها را در حالت دائمی “آماده رشد” نگه میدارد، فارغ از سیگنالهای خارجی. این امر باعث میشود که آنها منابع گلوکز و اسیدهای آمینه را به سرعت مصرف کنند.
۳.۲. مسیر سیگنالینگ AMPK: ترمز متابولیک و حسگر انرژی پایین
آنزیم پروتئین کیناز فعال شده توسط AMP (AMPK) رقیب مستقیم و متقابل mTOR است. AMPK زمانی فعال میشود که سطح انرژی سلول پایین بیاید؛ یعنی نسبت AMP به ATP افزایش یابد ([ \text{AMP} / \text{ATP} ] $\uparrow$). این حالت، نشاندهنده استرس انرژی یا کمبود مواد مغذی است.
وقتی AMPK فعال میشود، چندین اتفاق مهم رخ میدهد که همگی با رشد سلولی در تضاد هستند:
- مهار mTOR: AMPK به طور مستقیم یا غیرمستقیم از طریق فعالسازی TSC2 یا مهار mTORC1، مسیر رشد را خاموش میکند.
- افزایش جذب گلوکز (در بافتهای غیر سرطانی): در سلولهای سالم، AMPK باعث انتقال گیرندههای GLUT4 به سطح غشا شده و جذب گلوکز را برای تولید ATP افزایش میدهد.
- افزایش اکسیداسیون اسیدهای چرب: AMPK متابولیسم را به سمت مصرف سوختهای ذخیرهشده (مانند چربی) برای تولید انرژی سوق میدهد.
۳.۳. تأثیر ورزش بر تعادل mTOR/AMPK
فعالیت بدنی، به ویژه ورزشهای مقاومتی و اینتروال با شدت بالا (HIIT)، یک شوک متابولیک کنترلشده به بدن وارد میکند. در حین ورزش شدید، عضلات به شدت ATP مصرف میکنند که منجر به افزایش سریع نسبت [ \text{AMP} / \text{ATP} ] در سلولهای عضلانی میشود. این امر باعث فعالسازی گسترده AMPK میگردد.
نکته کلیدی: فعالسازی AMPK در سلولهای سالم، بدن را وادار به بهینهسازی مصرف انرژی میکند. با این حال، در بافت تومورال که غالباً دارای نقص در این تنظیمگری است، این فعالسازی (یا تغییر در محیط سلولی ناشی از ورزش) میتواند تفاوتهای حیاتی ایجاد کند:
- رقابت بر سر گلوکز: ورزش باعث میشود عضلات حساس به انسولین شوند و گلوکز بیشتری را از جریان خون جذب کنند. این کاهش موقت سطح گلوکز سرم، محیطی را ایجاد میکند که تومورها برای حفظ نرخ بالای گلیکولیز خود دچار کمبود شوند.
- اختلال در سیگنالینگ تومور: فعالسازی سیستماتیک AMPK توسط ورزش میتواند در نهایت منجر به سرکوب غیرمستقیم مسیر mTOR در سلولهای سرطانی نیز شود، زیرا محیط غنی از سیگنالهای ضد رشد و کاهشدهنده انرژی فراهم میشود.
شرح کامل مطالعه دانشگاه ییل روی موشها: بینش از مدل حیوانی
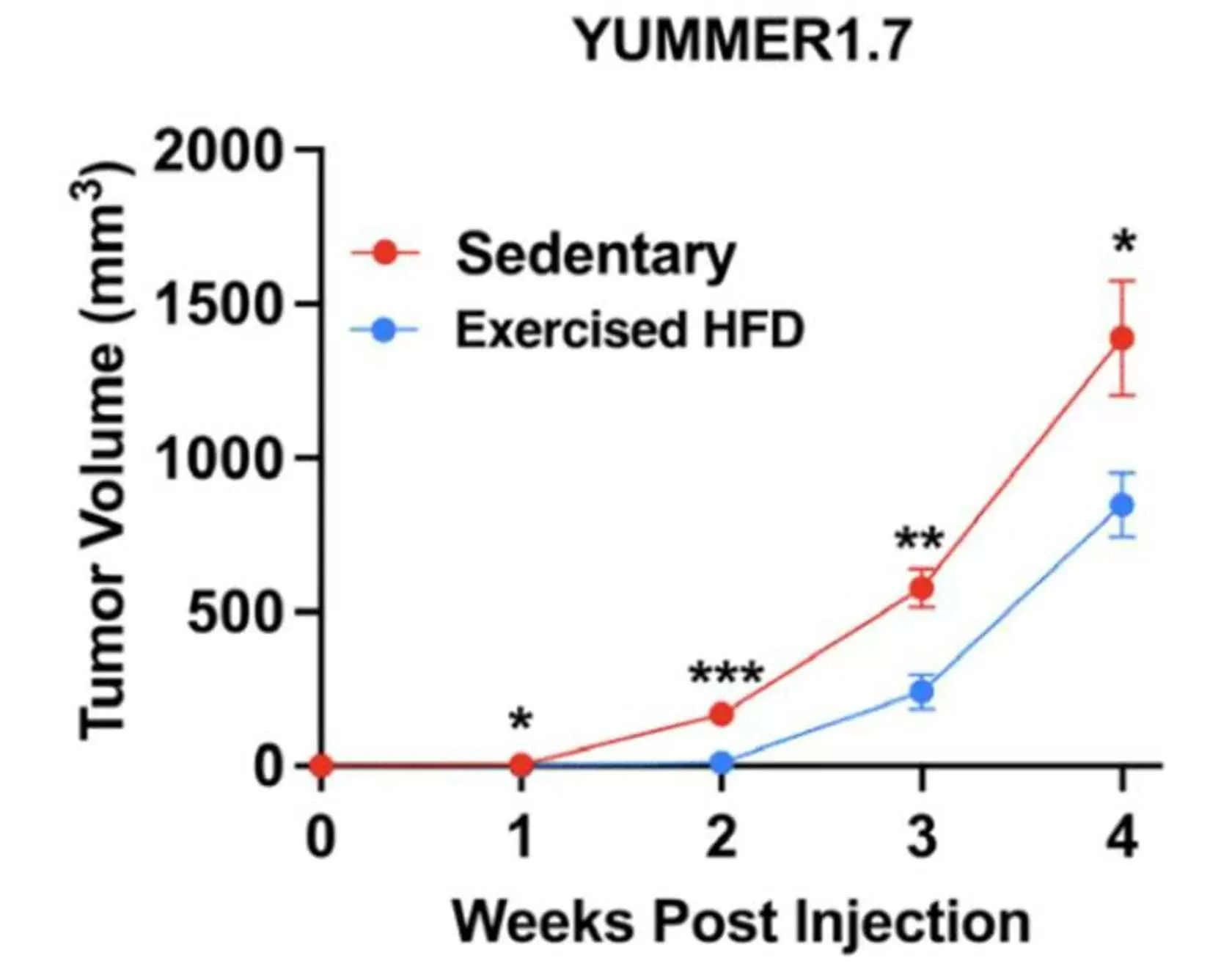
یکی از تأثیرگذارترین تحقیقات اخیر که مکانیسمهای مولکولی کاهش خطر سرطان توسط ورزش را روشن ساخت، مطالعهای بود که توسط محققان دانشگاه ییل (Yale University) بر روی موشها انجام شد و یافتههای آن در ژورنال PNAS منتشر گردید. این مطالعه فراتر از مشاهدات اپیدمیولوژیک رفت و توانست یک زنجیره علت و معلولی مستقیم بین ورزش، تغییرات متابولیک و مهار رشد تومور را در سطح مولکولی ترسیم کند.
۴.۱. طراحی آزمایش و مدلهای مورد استفاده
محققان از مدلهای موشی استفاده کردند که به طور ژنتیکی مستعد ابتلا به نوع خاصی از سرطان بودند (معمولاً مدلهای هیبریدی که مستعد توسعه تومورهای بافت نرم یا تومورهای داخلی بودند). یک گروه از موشها تحت یک برنامه ورزشی شدید و کنترلشده (معمولاً دویدن روی تردمیل یا چرخهای ورزشی) قرار گرفتند، در حالی که گروه کنترل فاقد فعالیت بود. سپس تیم تحقیقاتی به مقایسه بیان ژن، متابولوم و پاسخهای سیگنالینگ بین دو گروه پرداخت.
هدف اصلی، شناسایی تغییراتی بود که پس از تحریک ورزش، در محیط داخلی بدن موشها رخ داده و بر رشد تومورهای کاشته شده یا خودبهخودی تأثیر میگذاشت.
۴.۲. کشف ژنهای هدفمند: نقش 417 ژن کلیدی
بخش انقلابی این تحقیق، تحلیل جامع ژنومیک و ترانسکریپتومیک بود. محققان با استفاده از روشهای توالییابی RNA (RNA-Seq)، سطح بیان بیش از ۴۱۷ ژن مرتبط با متابولیسم و رشد سلولی را در بافتهای مختلف (عضله، کبد، و خود تومورها) مقایسه کردند.
این تحلیل نشان داد که ورزش نه تنها بر بافت فعال (عضله) تأثیر میگذارد، بلکه سیگنالهای سیستمیک را به بافتهای دوردست (تومور) ارسال میکند. تغییرات قابل توجهی در بیان ژنهایی مشاهده شد که مستقیماً با استفاده از گلوکز، میتوکندری و مسیرهای التهابی مرتبط بودند.
یافتههای اصلی بر اساس دستهبندی ژنی:
- مسیرهای متابولیک مرتبط با گلوکز: کاهش بیان ژنهایی که به جذب یا استفاده از گلوکز کمک میکنند در تومورها، یا افزایش بیان ژنهایی که گلوکز را به سمت مسیرهای غیرتکثیری هدایت میکنند.
- مسیرهای التهابی و ایمنی: تعدیل مثبت ژنهایی که پاسخهای ایمنی ضد تومور را تقویت میکنند (مانند اینترفرونها) و سرکوب ژنهای پیشالتهابی.
- مسیرهای آنژیوژنز (تشکیل عروق خونی): کاهش بیان فاکتورهای رشد اندوتلیال عروقی (VEGF) در محیط تومور، که نشاندهنده تضعیف توانایی تومور برای ایجاد شبکه خونرسانی جدید است.
۴.۳. مشاهده مستقیم گرسنگی تومور
مهمترین نتیجه این مطالعه، مشاهده مستقیم اثر «گرسنگی» تومور بود. موشهایی که ورزش کرده بودند، تومورهایی با نرخ رشد کندتر، حجم کمتر، و نفوذ کمتری به بافتهای اطراف نشان دادند. تجزیه و تحلیل بافتی این تومورها نشان داد که:
- کاهش هیپوکسی (کمبود اکسیژن): تومورهای ناشی از ورزش، با وجود رشد کندتر، دارای نواحی کمتری از نکروز (مرگ بافتی ناشی از کمبود مواد مغذی و اکسیژن) بودند، که نشاندهنده اختلال در فرآیندهای متابولیک داخلی تومور بود.
- تغییر در مصرف سوبسترا: محققان دریافتند که سلولهای تومورال در موشهای ورزشکار، منابع انرژی حیاتی خود را به طور کارآمدتری از دست میدهند یا مسیرهای جایگزین کمبازدهتری را اتخاذ میکنند که رشد تهاجمی را پشتیبانی نمیکند.
این مطالعه چارچوبی بیوشیمیایی فراهم آورد که نشان داد ورزش نه تنها به طور غیرمستقیم از طریق کاهش چربی بدن عمل میکند، بلکه تأثیرات فوری و مستقیمی بر دینامیک انرژی سلولهای سرطانی دارد.
مفهوم گرسنگی تومور (Tumor Starvation): فراتر از اثرات سیستمیک
مفهوم «گرسنگی تومور» در زمینه فعالیت بدنی به معنای ایجاد محیطی متابولیکی است که در آن تومور، با وجود حضور در بدن میزبان، به دلیل کمبود منابع حیاتی (عمدتاً گلوکز و اسیدهای آمینه) قادر به حفظ نرخ بالای تقسیم سلولی خود نیست. این مکانیسم به طور مستقیم با رویکرد درمانی سنتی که تلاش میکند با جراحی یا پرتو، تومور را از بین ببرد، متفاوت است؛ در اینجا هدف، خلع سلاح متابولیکی تومور است.
۵.۱. رقابت بر سر گلوکز: بازی سهمیهبندی
همانطور که قبلاً اشاره شد، سلولهای سرطانی به شدت وابسته به جذب و مصرف گلوکز هستند (اثر واربرگ). ورزش، به ویژه در فاز حاد و بلافاصله پس از تمرین، دو مکانیسم رقابتی ایجاد میکند:
- تقاضای عضلانی (Muscle Demand): عضلات در حین و پس از ورزش نیاز شدید به گلوکز برای بازسازی ذخایر گلیکوژن و ترمیم دارند. این تقاضا، سطح گلوکز آزاد در گردش خون را کاهش میدهد.
- افزایش کارایی GLUT4: ورزش باعث میشود عضلات اسکلتی با کارایی بسیار بالاتری گیرندههای انتقالدهنده گلوکز (GLUT4) را به سطح سلول بیاورند، حتی در غیاب انسولین کافی.
این دو عامل به طور همزمان باعث میشوند که گلوکز کمتری برای سلولهای تومورال باقی بماند. اگر سلول سرطانی نتواند به سرعت به منابع انرژی جایگزین (مانند اسیدهای چرب یا کتونها) سوئیچ کند، رشد آن کند شده و ورود به آپوپتوز (مرگ برنامهریزیشده سلولی) تسهیل میشود.
۵.۲. محدودیت اسیدهای آمینه و مهار سنتز پروتئین
تومورها علاوه بر گلوکز، برای ساخت پروتئینهای جدید مورد نیاز برای تقسیم سلولی، به شدت به اسیدهای آمینه وابسته هستند، به ویژه لوسین و گلوتامین.
ورزش بر متابولیسم اسیدهای آمینه نیز تأثیر میگذارد. در فاز ریکاوری پس از ورزش طولانی یا شدید، بدن ممکن است برخی اسیدهای آمینه خاص را برای ترمیم بافت عضلانی بسیج کند. مهمتر از آن، غیرفعال شدن mTOR توسط فعالسازی AMPK مستقیماً سنتز پروتئین را کاهش میدهد. از آنجا که mTOR سیگنال اصلی برای ترجمه mRNA به پروتئین است، کاهش فعالیت آن، حتی با وجود منابع کافی، میتواند سرعت تولید ماشینآلات تکثیری تومور را کاهش دهد.
۵.۳. تداخل با مسیرهای ساختمانی (Anabolism)
تومورها باید دائماً لیپیدها، نوکلئوتیدها و پروتئینها را بسازند (فرایندهای آنابولیک). این فرایندها نیازمند انرژی فراوان (NADPH و ATP) هستند. ورزش با ایجاد یک تعادل انرژی منفی (حتی موقت)، منابع مورد نیاز برای مسیرهای آنابولیک ضروری برای رشد سریع تومور را محدود میکند.
تحلیل ژنتیکی: کاوشی عمیقتر در میان ۴۱۷ ژن
مطالعه دانشگاه ییل، پتانسیل ورزش برای ایجاد تغییرات پایدار در رونویسی ژن را برجسته کرد. بررسی ۴۱۷ ژن منتخب، نمایانگر یک “اثر انگشت” مولکولی است که نشان میدهد چگونه بدن با فعالیت بدنی سازگار میشود و این سازگاری چگونه بر سلولهای سرطانی تأثیر میگذارد. این ژنها در دستهبندیهای زیر قرار میگیرند:
۶.۱. ژنهای مسیر متابولیسم انرژی (Glycolysis & Oxidative Phosphorylation)
بخش بزرگی از ژنهای مورد بررسی مستقیماً با نحوه تولید ATP مرتبط بودند. در بافتهای سالم تحریکشده توسط ورزش، اغلب افزایش در بیان ژنهای مرتبط با اکسیداسیون اسیدهای چرب (مانند سنسورهای میتوکندریایی) مشاهده میشود. در مقابل، در مواجهه تومور با محیط پس از ورزش، شاهد سرکوب بیان ژنهای کلیدی گلیکولیز مانند Hexokinase 2 (HK2) و Lactate Dehydrogenase A (LDHA) بودیم. این ژنها مسئول قفل کردن گلوکز درون سلول و تبدیل آن به لاکتات هستند؛ سرکوب آنها باعث کاهش سرعت مصرف گلوکز توسط تومور میشود.
۶.۲. ژنهای فاکتورهای رشد و بقا
این دسته شامل ژنهایی است که رشد سلولی را کد میکنند یا از آپوپتوز جلوگیری مینمایند:
- Bcl-2 و Bcl-xL: ژنهای ضد آپوپتوز. کاهش بیان آنها به این معنی است که سلولهای تومورال آسیبدیده یا محروم از مواد مغذی، راحتتر مسیر مرگ برنامهریزی شده را طی میکنند.
- VEGF و Angiopoietins: کاهش سطح ژنهایی که فاکتورهای رشد عروقی را کد میکنند، به طور مستقیم بر آنژیوژنز تومورال اثر میگذارد. توموری که عروق جدید نتواند بسازد، به ناچار از نظر مواد مغذی محدود میشود و رشد آن متوقف میگردد.
۶.۳. ژنهای تنظیمکننده سایکل سلولی (Cell Cycle Regulators)
ورزش با افزایش بیان ژنهای مهارکننده سایکل سلولی، باعث میشود سلولهای سرطانی در مرحله G1 یا G2/M متوقف شوند.
- p21 و p27: اینها مهارکنندههای کلین (Cyclin-Dependent Kinase Inhibitors) هستند. افزایش بیان آنها نشاندهنده این است که سلولها تحت شرایط تنش متابولیک ناشی از ورزش، از تقسیم سریع خودداری میکنند. این اثر در مدلهای حیوانی مشاهده شد و نشان داد ورزش سیگنال توقف تکثیر را به هسته سلول تومورال میفرستد.
۶.۴. تعامل با ژنهای میتوکندریایی
تحقیقات نشان میدهند که ورزش باعث بهبود عملکرد و زیستزایی میتوکندریها (Mitochondrial Biogenesis) در بافتهای سالم میشود. این بهبود کارایی، بدن را قادر میسازد تا در شرایط استرس، انرژی خود را از چربیها تولید کند و وابستگی خود را به گلوکز کاهش دهد. تومورها، به دلیل نقص در عملکرد میتوکندری (وابستگی به گلیکولیز)، در این رقابت انرژی عقب میمانند.
محدودیتهای مطالعه حیوانی و چالشهای ترجمه به انسان
اگرچه مطالعات حیوانی، به ویژه مدلهای پیشرفته دانشگاه ییل، بینشهای مکانیکی بینظیری ارائه میدهند، انتقال نتایج مستقیم آنها به جمعیت انسانی با چالشهای متعددی همراه است که باید در هر تحلیل علمی لحاظ شوند.
۷.۱. تفاوت در فیزیولوژی و محیط تومور
موشهای آزمایشگاهی اغلب مدلهای دارای نقص ایمنی هستند تا تومور بتواند بدون رد شدن رشد کند. سیستم ایمنی انسان بسیار پیچیدهتر است و پاسخهای التهابی و ایمنی آن به ورزش، تفاوتهای بنیادینی با موشها دارد.
- فعالیت متابولیک: دوز ورزشی که برای موشها “شدید” تلقی میشود، ممکن است به طور متفاوتی بر متابولیسم گلوکز در انسان تأثیر بگذارد، زیرا نسبت سطح بدن به توده عضلانی متفاوت است.
۷.۲. کنترل شدت و دوز ورزش
یکی از بزرگترین موانع، تعریف “دوز” بهینه ورزش است. در مدلهای حیوانی، میتوان شدت و مدت زمان ورزش را با دقت میلیثانیهای کنترل کرد. در انسان، عوامل دخیل مانند تغذیه، استرس، و ترکیب بدنی، متغیرهایی هستند که قابل اندازهگیری دقیق نیستند.
آیا ورزش روزانه با شدت متوسط کافی است، یا یک دوره تمرین شدید اینتروال (HIIT) مورد نیاز است تا تغییرات ژنی مشاهده شده در موشها در انسان تکرار شود؟ در حال حاضر، دادهها حاکی از آن است که هر دو نوع ورزش اثرات محافظتی دارند، اما ممکن است بر مکانیسمهای متفاوتی در شدتهای متفاوت تأثیر بگذارند.
۷.۳. زمانبندی مواجهه با تومور (Timing of Exposure)
در مطالعات حیوانی، معمولاً حیوانات قبل از القای تومور شروع به ورزش میکنند (پیشگیری اولیه). در جمعیتهای انسانی، بسیاری از افراد زمانی ورزش را شروع میکنند که یا در معرض خطر بالا هستند یا تشخیص سرطان دادهاند (پیشگیری ثانویه یا کمکی).
تأثیر ورزش بر تومورهای اولیه شکلگرفته در مقایسه با جلوگیری از شکلگیری تومور، هنوز نیازمند تفکیک دقیقتری است.
امکان تعمیم به انسان: ترجمه مکانیسمها
با وجود محدودیتهای مدل حیوانی، شواهد اپیدمیولوژیک قوی و مشاهدات بیوشیمیایی در انسانها، نشان میدهند که اصل اساسی «گرسنگی تومور» از طریق ورزش در انسانها نیز قابل اعمال است.
۷.۴. شواهد بالینی: تغییرات متابولیک در بیماران
مطالعات بالینی بر روی بیماران مبتلا به سرطان پستان و کولورکتال نشان میدهد که برنامههای ورزشی ساختارمند میتوانند منجر به تغییرات مثبتی شوند که با مکانیسمهای کشفشده در موشها همسو است:
- کاهش نشانگرهای رشد سیستمیک: اندازهگیری سطح IGF-1 و انسولین در سرم خون بیماران پس از دورههای تمرینی طولانیمدت، کاهش این عوامل رشد را تأیید میکند.
- بهبود پروفایل سیتوکینها: بیمارانی که فعالتر هستند، سطوح پایینتری از سیتوکینهای پیشالتهابی را نشان میدهند که به معنای کاهش التهاب مزمن در میکرو محیط تومور است.
- بهبود کیفیت زندگی و تحمل درمان: ورزش به طور گستردهای اثبات کرده است که تحمل بیماران را نسبت به شیمیدرمانی و پرتودرمانی افزایش میدهد، که این خود نشاندهنده بهبود وضعیت متابولیک و کاهش خستگی مرتبط با سرطان (Cancer-Related Fatigue) است.
۷.۵. مکانیسمهای ایمنی انسانی در پاسخ به ورزش
در انسان، تأثیر ورزش بر سیستم ایمنی قویتر و پیچیدهتر است. ورزش باعث افزایش گردش سلولهای NK و T، و افزایش بیان مولکولهای چسبندگی در اندوتلیوم میشود که به “شستشوی” سلولهای تومورال در گردش خون (Circulating Tumor Cells – CTCs) کمک میکند و اجازه نمیدهد این سلولها به راحتی در اندامهای دوردست کاشته شوند (متاستاز اولیه).
نقش شدت و مدت ورزش: تنظیم دوز ضد سرطان
تأثیر ورزش صرفاً به “انجام آن” محدود نمیشود؛ بلکه به چگونگی انجام آن بستگی دارد. شدت و مدت زمان، دو متغیر حیاتی در تنظیم پاسخهای بیولوژیکی هستند.
۷.۶. شدت ورزش (Intensity): فعالسازی شوک متابولیک
شدت بالاتر ورزش (مانند تمرینات اینتروال با شدت بالا – HIIT) احتمالاً قویترین محرک برای فعالسازی پاسخهای ضد توموری فوری است.
- فعالسازی حداکثری AMPK: شدت بالا به سرعت نسبت [ \text{AMP} / \text{ATP} ] را افزایش داده و AMPK را به شدت فعال میکند. این فعالسازی سریع برای مهار کوتاهمدت مسیر mTOR حیاتی است.
- افزایش کاتکولامینها: تمرینات شدید باعث ترشح آدرنالین و نوراپینفرین میشود که میتوانند به طور مستقیم بر سلولهای تومورال اثر بگذارند و باعث مرگ آنها یا کاهش چسبندگی سلولی شوند.
- تولید متابولیتهای کمکی: ورزش شدید میتواند باعث ترشح میوکینهایی (Myokines) از عضلات فعال شود که نقشهای پاراکرین و اندوکرین در تعدیل محیط تومور دارند.
۷.۷. مدت ورزش (Duration): اثرات مزمن و ژنتیکی
در حالی که شدت بر پاسخهای حاد تأثیر میگذارد، مدت زمان و تداوم ورزش برای ایجاد تغییرات پایدار در سطح ژنتیکی (مانند آنچه در مدل ۴۱۷ ژنی مشاهده شد) ضروری است.
- بهبود حساسیت به انسولین: اثرات بلندمدت ورزش بر بهبود حساسیت به انسولین در تمام بافتها، یک اثر محافظتی مزمن ایجاد میکند که وابستگی تومور به منابع قندی را کاهش میدهد.
- بازآرایی بافت چربی: کاهش چربی احشایی و تغییر پروفایل سایتوکینهای ترشحشده از بافت چرب، یک تغییر محیطی پایدار ایجاد میکند که التهاب سیستمیک را کاهش میدهد و به پیشگیری از تومورزایی کمک میکند.
به طور خلاصه، شدت بالا برای القای شوک متابولیک مورد نیاز جهت گرسنگی کوتاهمدت تومور، و مدت طولانی و تداوم برای ایجاد تغییرات متابولیک سیستمی بلندمدت حیاتی است.
تفاوت انواع ورزش: رویکردهای مکمل
مکانیسمهای دقیق اثر ورزش بر سرطان بسته به نوع فعالیت (هوازی، مقاومتی، یا ترکیبی) میتواند متفاوت باشد، که هر کدام جنبهای از مهار تومور را هدف قرار میدهند.
۸.۱. ورزشهای هوازی (استقامتی)
این نوع ورزش (مانند دویدن طولانی، شنا و دوچرخهسواری) بر بهبود کارایی سیستم قلبی-تنفسی و متابولیسم چربیها تأکید دارد.
- نقش اصلی: کاهش وزن بدن، بهبود پروفایل لیپیدی، کاهش التهاب مزمن، و افزایش حساسیت به انسولین در طول زمان. این ورزشها در پیشگیری از سرطانهای مرتبط با چاقی و متابولیسم (مانند سرطان روده بزرگ) بسیار مؤثر هستند.
- مکانیسم سلولی: ترویج میتوکندریوژنز و بهبود توانایی بدن برای استفاده از اکسیژن، که میتواند فشار بر تومورهای هیپوکسیک را افزایش دهد.
۸.۲. ورزشهای مقاومتی (قدرتی)
تمرینات با وزنه یا تمرینات مقاومتی با وزن بدن بر حفظ و افزایش توده عضلانی تأکید دارند.
- نقش اصلی: حفظ توده عضلانی با افزایش سن بسیار مهم است، زیرا توده عضلانی اصلیترین محل ذخیره گلوکز و اسیدهای آمینه در بدن است. افزایش توده عضلانی، ظرفیت رقابت بدن با تومور برای جذب مواد مغذی را افزایش میدهد.
- مکانیسم سلولی: تمرین مقاومتی شدید، فعالسازی mTOR را در عضله تقویت میکند تا به ترمیم و رشد بپردازد، اما این فعالسازی “سالم” است و با سیگنالهای رشد کنترلشده همراه است که با مهارکنندههای رشد تومور در تضاد است. همچنین این نوع ورزش قویترین محرک برای تولید برخی میوکینها است.
۸.۳. تمرینات اینتروال با شدت بالا (HIIT)
HIIT ترکیبی از دورههای کوتاه ورزش با شدت بالا و دورههای استراحت کوتاه است.
- نقش اصلی: فراهم کردن تحریک متابولیک قوی (فعالسازی شدید AMPK) در مدت زمان کوتاهتر. برای افرادی که زمان محدودی دارند، HIIT میتواند بیشترین اثر را بر بهبود سریع پارامترهای متابولیک داشته باشد.
- تطابق با مدل ییل: این نوع ورزش به دلیل ایجاد شوک انرژی سریع، شبیهترین اثر را به محرکهای مورد استفاده در مدلهای آزمایشگاهی برای القای تغییرات کوتاهمدت در محیط تومور دارد.
کاربردهای بالینی آینده: ورزش در پروتکلهای درمانی
درک این مکانیسمها راه را برای ادغام ورزش به عنوان یک “درمان کمکی” (Adjuvant Therapy) در پروتکلهای استاندارد آنکولوژی باز میکند.
۸.۴. ورزش قبل از جراحی (Prehabilitation)
یکی از هیجانانگیزترین کاربردها، استفاده از ورزش برای بهینهسازی وضعیت بیمار قبل از مداخلات سنگین مانند جراحی یا پیوند مغز استخوان است.
- بهبود تحمل جراحی: بیماران با آمادگی جسمانی بالاتر، عوارض کمتری را پس از عمل تجربه میکنند و زمان بستری کوتاهتر میشود.
- تقویت ایمنی ضد تومور: فعالسازی سیستم ایمنی پیش از برداشتن تومور اولیه، ممکن است شانس بقای سلولهای سرطانی در گردش خون را کاهش دهد.
۸.۵. مدیریت عوارض جانبی درمان (Survivorship Care)
ورزش به عنوان یک مداخله استاندارد برای کاهش عوارض جانبی درمانهای سرطان، مانند نوروپاتی محیطی ناشی از شیمیدرمانی، خستگی و تحلیل عضلانی (Cachexia) در حال تبدیل شدن است. این اثرات به طور غیرمستقیم به بقای بیمار کمک میکنند، زیرا امکان ادامه درمانهای اصلی را فراهم میآورند.
۸.۶. ورزش در ترکیب با درمانهای هدفمند
آیا ورزش میتواند اثربخشی داروهای هدفمند را افزایش دهد؟ به نظر میرسد بله.
- مهارکنندههای mTOR: اگر دارویی مسیر mTOR را مهار کند و همزمان ورزش باعث فعالسازی AMPK (مهارکننده mTOR) شود، ممکن است اثر سینرژیک (همافزایی) بر خاموش کردن مسیر رشد تومور حاصل شود.
- تأثیر بر فراهمی مواد مغذی: اگر دارویی بر جذب گلوکز اثر بگذارد، ورزش با کاهش گلوکز موجود در محیط، این دارو را مؤثرتر میسازد.
دیدگاه آنکولوژی دقیق (Precision Oncology) و ورزش
آینده درمان و پیشگیری سرطان شامل انطباق مداخلات با مشخصات مولکولی فردی است. ورزش نیز از این قاعده مستثنی نیست.
۸.۷. پروفایلسازی ژنتیکی بیمار
در آینده، توصیه ورزشی ممکن است بر اساس پروفایل ژنتیکی بیمار شخصیسازی شود:
- بیماران با تومورهای با شیفت گلیکولیتیک بالا: این بیماران احتمالاً بیشترین بهره را از برنامههای ورزشی میبرند که بر محدود کردن دسترسی به گلوکز (مانند تمرینات بر پایه متابولیسم هوازی طولانیمدت) تمرکز دارند.
- بیماران با اختلال در تنظیم ایمنی: این افراد ممکن است نیاز به ورزشهایی داشته باشند که به طور خاص بر افزایش تعداد و فعالیت سلولهای NK و T سیتوتوکسیک در کوتاهمدت تمرکز کند.
۸.۸. بیومارکرهای پاسخ به ورزش
شناسایی بیومارکرهایی که نشان میدهند یک فرد به برنامه ورزشی پاسخ متابولیک مناسبی داده است (مثلاً افزایش موقت ترشح یک میوکین خاص یا کاهش پایدار CRP)، میتواند به پزشکان کمک کند تا دوز و نوع ورزش را تنظیم کنند، درست مانند تنظیم دوز دارو.
۸.۹. ورزش به عنوان تعدیلکننده محیط ریزتومور (TME)
دیدگاه آنکولوژی دقیق، فراتر از سلول سرطانی، بر محیط اطراف آن (TME) نیز تمرکز دارد. ورزش با کاهش عوامل التهابی، تضعیف شبکه عروقی غیرطبیعی تومور و کاهش فشار در فضای بین سلولی، TME را “سالمتر” میکند، در نتیجه تومور را در برابر مکانیسمهای دفاعی بدن آسیبپذیرتر میسازد.
جمعبندی تحلیلی: ورزش، استراتژی پایدار گرسنگی تومور
تحلیلهای اخیر، از جمله یافتههای کلیدی مبتنی بر مطالعه مدلهای حیوانی و تحلیل ۴۱۷ ژن مرتبط، تأیید میکنند که ورزش نه یک مداخله حاشیهای، بلکه یک عامل تعدیلکننده بیولوژیکی قدرتمند در مبارزه با سرطان است. مکانیسم اصلی، ایجاد یک عدم توازن متابولیک هدفمند است که به طور مؤثر تومورها را به سمت گرسنگی هدایت میکند.
خلاصه مسیرهای اصلی:
- تعدیل سیگنالینگ: ورزش با فعالسازی AMPK، مسیرهای رشد وابسته به mTOR را در سراسر بدن مهار میکند.
- رقابت سوبسترا: افزایش تقاضای عضلات برای گلوکز، منابع حیاتی تومور را کاهش میدهد.
- تغییر رونویسی ژن: ورزش به طور پایدار بیان ژنهای مرتبط با التهاب و تکثیر را در جهت سرکوب تومور تغییر میدهد.
در حالی که تحقیقات بیشتری برای تعیین دوز دقیق و شخصیسازی مداخلات مورد نیاز است، ورزش منظم، با شدت و نوع مناسب، به عنوان یک استراتژی پیشگیرانه کمخطر و با پتانسیل بالا برای مهار بقا و رشد سلولهای سرطانی در محیط بدن انسان تثبیت شده است. این رویکرد، مفهوم درمان سرطان را از حمله مستقیم به سلول بیمار، به سمت بهینهسازی محیط داخلی بدن برای نامناسب ساختن زندگی تومور، سوق میدهد.
سؤالات متداول (FAQ) در خصوص ورزش و مکانیسمهای ضد سرطان
در این بخش به ۲۰ سؤال رایج و عمیق در مورد ارتباط فعالیت بدنی و کاهش خطر سرطان بر اساس یافتههای علمی اخیر پاسخ داده شده است.
۱. سؤال: آیا کاهش خطر سرطان فقط به دلیل کاهش چربی بدن (کاهش وزن) است یا مکانیسمهای مستقیمی نیز وجود دارند؟
پاسخ: مکانیسمهای متعددی وجود دارند. اگرچه کاهش چربی احشایی و کاهش التهاب سیستمیک ناشی از کاهش وزن، یک عامل محافظتی بزرگ است، مطالعات مولکولی (مانند پژوهشهای مبتنی بر تحلیل ژنومیک) نشان میدهند که ورزش اثرات مستقیمی نیز دارد. این اثرات شامل فعالسازی AMPK، تغییر در سیگنالینگ انسولین/IGF-1، و تنظیم مستقیم مسیرهای متابولیک در سطح سلولهای تومورال است، که مستقل از کاهش وزن رخ میدهند.
۲. سؤال: کدام مسیر سیگنالینگ بین AMPK و mTOR نقش محوری در مهار رشد تومور توسط ورزش دارد؟
پاسخ: مسیر AMPK (آنزیم پروتئین کیناز فعال شده توسط AMP) نقش محوری دارد. ورزش، با افزایش مصرف ATP و افزایش نسبت AMP/ATP، AMPK را فعال میکند. AMPK فعال، کیناز mTORC1 را مهار میکند. mTORC1 مسیر اصلی رشد، سنتز پروتئین و تکثیر سلولی است؛ بنابراین، غیرفعال کردن آن توسط AMPK، به طور مستقیم رشد سلولهای سرطانی را کند میسازد و آنها را به سمت وضعیت استرس انرژی سوق میدهد.
۳. سؤال: مطالعه دانشگاه ییل دقیقاً چه تأثیری بر ژنهای مرتبط با سرطان نشان داد؟
پاسخ: این مطالعه (با بررسی حدود ۴۱۷ ژن) نشان داد که ورزش موجب تعدیل سیستمیک بیان ژنها میشود. به طور خاص، در محیط تومور، کاهش بیان ژنهای کلیدی گلیکولیز (مانند HK2 و LDHA) و کاهش فاکتورهای رشد عروقی (مانند VEGF) مشاهده شد. این تغییرات نشاندهنده تضعیف توانایی تومور برای تأمین انرژی و ایجاد خونرسانی جدید است.
۴. سؤال: منظور از “گرسنگی تومور” در ارتباط با ورزش چیست؟
پاسخ: گرسنگی تومور به وضعیتی گفته میشود که در آن، به دلیل تغییرات متابولیک القا شده توسط ورزش (مانند کاهش موقت گلوکز و اسیدهای آمینه در گردش خون)، تومور منابع لازم برای حفظ نرخ بالای تقسیم سلولی خود را از دست میدهد. این فرآیند، تومور را وادار میکند تا از حالت تکثیری به حالت بقا یا حتی مرگ برنامهریزیشده (آپوپتوز) برود.
۵. سؤال: آیا شدت ورزش (HIIT در مقابل استقامتی) در مهار تومور تفاوت دارد؟
پاسخ: بله، تفاوت دارند. شدت بالای ورزش (HIIT) بیشترین شوک حاد متابولیک را ایجاد کرده و قویترین محرک برای فعالسازی کوتاهمدت AMPK است که برای مهار فوری رشد حیاتی است. در مقابل، ورزشهای استقامتی (مدت طولانیتر) برای ایجاد تغییرات مزمن، مانند بهبود حساسیت به انسولین و کاهش پایدار التهاب، مؤثرتر هستند. هر دو نوع برای سلامت کلی ضد سرطان توصیه میشوند.
۶. سؤال: آیا ورزش بر متاستاز (گسترش سرطان) تأثیر میگذارد؟
پاسخ: بله، شواهد نشان میدهند که ورزش میتواند بر متاستاز تأثیر بگذارد. این اثر از طریق دو مسیر اصلی اعمال میشود: ۱. تقویت سیستم ایمنی (افزایش فعالیت سلولهای NK و T سیتوتوکسیک) که سلولهای تومورال در گردش خون را بهتر شناسایی میکنند؛ ۲. تضعیف آنژیوژنز تومورال (از طریق کاهش VEGF)، که مانع از ایجاد پلهای عروقی لازم برای مهاجرت تومور به اندامهای دوردست میشود.
۷. سؤال: چه کسانی (از نظر نوع سرطان) بیشترین سود را از ورزش میبرند؟
پاسخ: قویترین شواهد محافظتی مربوط به سرطانهای وابسته به هورمون و متابولیسم است: سرطان پستان، سرطان روده بزرگ (کولورکتال)، و سرطان آندومتر. این امر به دلیل تأثیر ورزش بر تنظیم سطح استروژن، انسولین و چربی بدن است.
۸. سؤال: اگر فردی تشخیص سرطان پیشرفته داشته باشد، آیا ورزش هنوز مفید است؟
پاسخ: قطعاً. در فاز پیشرفته، ورزش به عنوان یک درمان کمکی (Adjuvant) عمل میکند. این به بیماران کمک میکند تا تحمل بهتری نسبت به شیمیدرمانی و پرتودرمانی داشته باشند، عوارض جانبی را کاهش دهند (مانند خستگی و کاشکسی عضلانی)، و از نظر عملکردی قویتر بمانند، که این خود به طور غیرمستقیم بر پیشآگهی بیماری تأثیر مثبت میگذارد.
۹. سؤال: آیا میتوان انتظار داشت که ورزش به تنهایی سرطان را درمان کند؟
پاسخ: خیر. ورزش یک استراتژی پیشگیری بسیار قوی و یک مداخله کمکی مؤثر در درمان است، اما جایگزین درمانهای استاندارد مانند جراحی، پرتودرمانی و داروهای هدفمند نمیشود. هدف آن، تعدیل محیط بدن به گونهای است که سلولهای سرطانی نتوانند به طور مؤثر تکثیر شوند و سیستم درمانی بتواند مؤثرتر عمل کند.
۱۰. سؤال: مکانیسم دقیق افزایش حساسیت به انسولین توسط ورزش چیست؟
پاسخ: ورزش باعث میشود که عضلات اسکلتی، بدون نیاز به سیگنالدهی قوی انسولین، گیرندههای GLUT4 خود را به سطح غشا منتقل کنند و گلوکز را جذب نمایند. این افزایش کارایی، سطح گلوکز و انسولین آزاد در گردش خون را کاهش میدهد و در نتیجه، محرکهای رشد ناشی از هیپرانسولینمی برای تومورها کاهش مییابد.
۱۱. سؤال: آیا نوع تومور از نظر متابولیکی (مثلاً تومورهای با واربرگ شدید) بر پاسخ به ورزش تأثیر میگذارد؟
پاسخ: بله. تومورهایی که شدیداً وابسته به گلیکولیز هوازی (اثر واربرگ) هستند، به احتمال زیاد بیشترین آسیب را از رقابت گلوکز ناشی از ورزش میبرند، زیرا آنها نمیتوانند به سرعت به متابولیسم چربی یا اکسیداسیون میتوکندریایی سوئیچ کنند، برخلاف سلولهای سالم که توسط ورزش به این مسیرها سوق داده میشوند.
۱۲. سؤال: چه نوع ورزشی برای تقویت عملکرد سیستم ایمنی علیه سرطان بهتر است؟
پاسخ: ورزشهای هوازی با شدت متوسط تا بالا، به ویژه تمرینات اینتروال (HIIT)، در افزایش گردش و فعالیت سلولهای کشنده طبیعی (NK) و سلولهای T سیتوتوکسیک در کوتاهمدت بسیار مؤثر هستند. این یک پاسخ حاد ایمنی است که به تقویت دیدهبانی ایمنی کمک میکند.
۱۳. سؤال: آیا محدودیتهای مدل حیوانی واقعاً قابل اغماض است؟
پاسخ: خیر، قابل اغماض نیستند. تفاوتهای فیزیولوژیکی، به ویژه در سیستمهای ایمنی و متابولیک، بین موش و انسان وجود دارد. با این حال، مکانیسمهای اصلی سیگنالینگ (مانند فعالسازی AMPK در برابر mTOR) در پستانداران به شدت محفوظ ماندهاند، بنابراین اصل مکانیسم قابل تعمیم است، هرچند دوز دقیق و زمانبندی پاسخها متفاوت خواهد بود.
۱۴. سؤال: آیا ورزش برای بیماران تحت درمانهای هدفمند مانند مهارکنندههای CDK4/6 مفید است؟
پاسخ: به احتمال زیاد بله. اگرچه مطالعات مستقیمی محدود است، از آنجا که ورزش باعث القای مهارکنندههای سایکل سلولی (مانند p21 و p27) در سلولهای سالم میشود، میتواند با داروهایی که هدفشان توقف سایکل سلولی است، همافزایی ایجاد کند و تقسیم سلولی تومور را دو برابر کند کند.
۱۵. سؤال: چقدر زمان باید بین جلسه ورزش و مصرف وعده غذایی اصلی برای به حداکثر رساندن اثر گرسنگی تومور فاصله باشد؟
پاسخ: این موضوع هنوز به طور کامل در انسان مشخص نشده است. اما منطق بیولوژیکی حکم میکند که باید یک پنجره زمانی وجود داشته باشد که در آن عضلات به شدت گلوکز را مصرف میکنند و سطح گلوکز سرم پایین است. این معمولاً در فاز ریکاوری فعال (حدود ۳۰ تا ۶۰ دقیقه پس از تمرین شدید) رخ میدهد. مصرف مواد مغذی نباید بلافاصله پس از ورزش سنگین باشد تا این “گرسنگی” محیطی تشدید شود.
۱۶. سؤال: ورزش چگونه بر تشکیل عروق خونی جدید توسط تومور (آنژیوژنز) تأثیر میگذارد؟
پاسخ: ورزش با کاهش بیان فاکتورهای رشد اندوتلیال عروقی (VEGF) و سایر مولکولهای القا کننده آنژیوژنز، تومور را از ساخت شبکه خونرسانی جدید محروم میکند. تومورهای بدون خونرسانی کافی، دچار کمبود اکسیژن و مواد مغذی شده و رشدشان متوقف میشود.
۱۷. سؤال: آیا مصرف مکملها میتواند اثر ورزشی ضد سرطان را تقویت کند؟
پاسخ: مکملهایی که بر مسیر AMPK تأثیر میگذارند (مانند مهارکنندههای گلوکونئوژنز یا موادی که متابولیسم میتوکندری را تقویت میکنند)، پتانسیل تقویت اثر ورزش را دارند. به عنوان مثال، برخی ترکیبات میتوانند عملکرد میتوکندری را در بافت سالم بهبود بخشند و رقابت بر سر منابع را به نفع بافت سالم افزایش دهند.
۱۸. سؤال: اگر فردی به دلیل بیماری نمیتواند ورزش شدید انجام دهد، آیا ورزش بسیار سبک (مانند پیادهروی) همچنان فایدهای دارد؟
پاسخ: بله، فایده دارد. حتی ورزش سبک پیوسته به کاهش التهاب مزمن سیستمیک کمک میکند (کاهش CRP و سیتوکینهای پیشالتهابی)، که خود یک عامل محافظتی مهم در برابر تومورزایی است. همچنین، تداوم فعالیت، از تحلیل سریع توده عضلانی که ذخیرهساز انرژی است، جلوگیری میکند.
۱۹. سؤال: آیا برای به حداکثر رساندن اثرات ضد سرطانی ورزش، نیاز به ورزش روزانه است؟
پاسخ: برای حفظ تغییرات متابولیک مزمن و پایدار در حساسیت به انسولین و التهاب، تداوم و فعالیت منظم ضروری است. با این حال، برای القای قویترین پاسخهای حاد (فعالسازی سریع AMPK)، دورههای تمرینی شدیدتر با فواصل استراحت کوتاهتر (مانند HIIT چند بار در هفته) بیشترین کارایی را دارند.
۲۰. سؤال: در آینده، آیا توصیههای ورزشی شخصیسازی خواهند شد؟
پاسخ: بله، هدف نهایی آنکولوژی دقیق، تطبیق ورزش با بیومارکرهای فردی است. این شامل استفاده از پروفایل ژنتیکی تومور بیمار (برای درک وابستگی آن به گلوکز یا چربی) و بیومارکرهای پاسخدهنده فرد (مانند تغییرات در میوکینها یا سطح گلوکز سرم پس از تمرین) برای تجویز “دوز” و “نوع” ورزشی بهینه است.