نگه داشتن بیمار در آستانه مرگ با ریه مصنوعی؛ جهشی تاریخی در پزشکی
نگهداشتن بیمار در آستانه مرگ با ریه مصنوعی؛ جهشی تاریخی در پزشکی
طنین سکوت در اتاق مراقبتهای ویژه
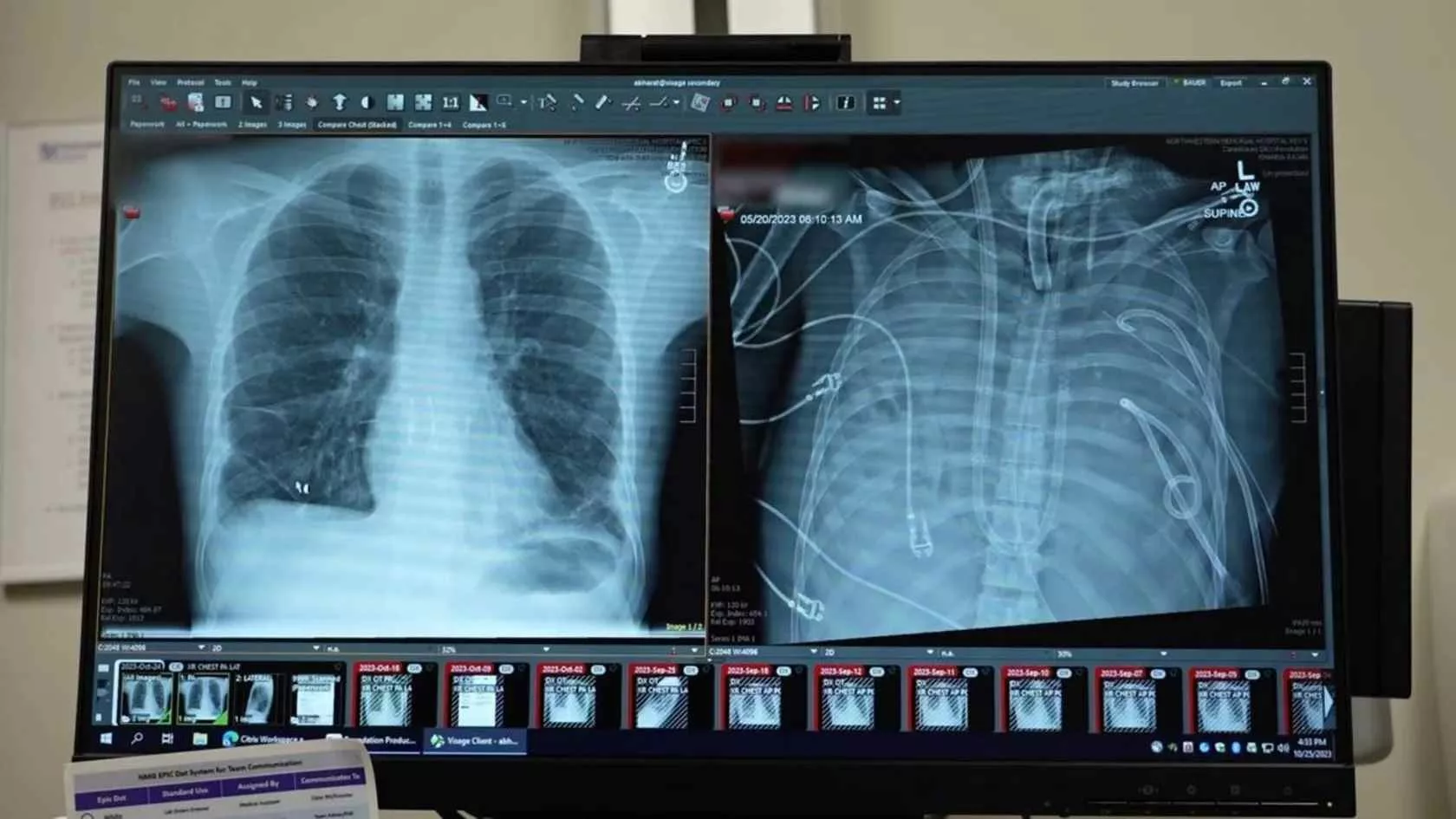
در قلب یکی از پیشرفتهترین مراکز پزشکی جهان، جایی که نبض فناوری با تپش زندگی درآمیخته است، داستانی در شرف وقوع بود که نه تنها مسیر درمان یک فرد، بلکه افق پزشکی مدرن را تغییر میداد. اتاق مراقبتهای ویژه (ICU) مملو از صدای ممتد دستگاههای مانیتورینگ بود؛ آوایی مصنوعی که در تقابل با سکوت مرگآور نبودنِ ریههای یک انسان قرار گرفته بود. این صحنه، روایتگر نبرد نهایی بیست و چند ساله، “دایمونت کلارک”، با نارسایی ریوی پیشرفته بود؛ نبردی که او در آن یکهوتنها بود و یارانش، پزشکان بودند که با سلاحی نوین به میدان آمده بودند: سیستمهای پیشرفته ریه مصنوعی برونبدنی (ECMO).
دایمونت، مانند هزاران بیمار دیگر، گرفتار بیماری مزمن انسدادی ریه (COPD) شده بود، اما وضعیت او به مرحلهای رسیده بود که هیچ درمان معمول، حتی تنفس با دستگاههای ونتیلاتور معمولی، قادر به اکسیژنرسانی کافی به بافتهای حیاتیاش نبود. ریههای او عملاً از کار افتاده بودند؛ اندامهایی که وظیفه حیاتی تبادل گازها را بر عهده دارند، تبدیل به تودههای غیرفعالی شده بودند که تنها بار سنگینی بر دوش کادر درمان بودند. در چنین شرایطی، پزشکان معمولاً تنها میتوانستند برای بیمار آرامش قبل از مرگ فراهم کنند. اما این بار، تیمی از متخصصان آمریکایی تصمیم گرفتند تا مرزهای ممکن را جابجا کنند؛ تصمیمی برای “نگهداشتن بیمار در آستانه مرگ با ریه مصنوعی”. این تلاش، صرفاً حفظ حیات نبود؛ بلکه نمایشی از مهندسی زیستی بود که طی آن، بدن بیمار به یک بیمارستان کوچک درونجسمی تبدیل میشد.
این مقاله به تشریح کامل این دستاورد تاریخی، فناوری پیچیده مورد استفاده، تفاوتهای ظریف آن با سایر روشهای حمایتی، و تأثیرات شگرفی که این رویداد بر آینده پیوند اعضا و مراقبتهای بحرانی خواهد گذاشت، خواهد پرداخت. این داستانی است از امید، دقت علمی و جهشی که شاید روزی به عنوان آغاز عصر جدیدی در نجات بیماران ریوی شناخته شود.
شرح کامل ماجرا: زمانی که امید به یک دستگاه گره خورد
نارسایی ریوی یک حکم اعدام تدریجی است. وقتی ریهها توانایی جذب اکسیژن و دفع دیاکسید کربن را از دست میدهند، بدن در یک مسیر سریع به سمت ایسکمی و مرگ سلولی پیش میرود. در مورد دایمونت، وضعیت او حادتر بود. او مدتها بود که وابستگی شدیدی به ونتیلاتورهای مکانیکی داشت، اما این دستگاهها فقط میتوانستند ریههای آسیبدیده را وادار به کار کنند؛ آنها نمیتوانستند نقش یک ریه سالم را ایفا کنند.
تیم پزشکی متوجه شد که ریههای دایمونت چنان آسیب دیدهاند که برای بهبودی نیاز به استراحتی مطلق دارند؛ استراحتی که باید طولانیتر از آن بود که بدن بتواند بدون حمایت کامل دوام بیاورد. اینجا بود که پای سیستم پیچیده حمایت تنفسی برونبدنی (Extracorporeal Membrane Oxygenation یا ECMO) به میان آمد.
ECMO: فراتر از یک ونتیلاتور ساده
ECMO فرآیندی است که در آن خون بیمار از بدن خارج شده، توسط دستگاهی (پمپ و اکسیژناتور) اکسیژنرسانی شده و دیاکسید کربن آن دفع میگردد و سپس خون تصفیهشده به بدن بازگردانده میشود. در حقیقت، این دستگاه وظیفه قلب و ریه بیمار را به طور همزمان یا فقط ریه (VA-ECMO یا VV-ECMO) بر عهده میگیرد.
در مورد دایمونت، تیم از VV-ECMO (Venovenous ECMO) استفاده کرد، زیرا قلب او هنوز کار میکرد، اما ریهها ناتوان بودند. خون وریدی (کماکسیژن) از بیمار خارج میشد، در دستگاه اکسیژنگیری میشد و سپس به سیستم وریدی بازمیگشت، در حالی که ریههای دایمونت در سکوت مطلق قرار گرفتند تا شاید فرصتی برای ترمیم بیابند. این فرآیند برای بیش از سه هفته ادامه یافت، رکوردی در مدیریت بیماران با این شدت آسیب.
معرفی بیمار: دایمونت کلارک و نبرد بیپایان
دایمونت کلارک، مردی اهل اوهایو، نمادی از میلیونها نفری بود که درگیر عوارض مهلک بیماریهای ریوی شدند. او سالها با COPD دست و پنجه نرم کرده بود و در نهایت، عفونتهای مکرر و فیبروز پیشرونده ریوی، تواناییهای تنفسی او را به صفر رسانده بودند. او نه تنها از نظر جسمی، بلکه از نظر روحی نیز در مرز تسلیم بود. امید او برای پیوند ریه به دلیل شرایط وخیم عمومی و کمبود اندامهای اهداکننده، بسیار کم بود.
پزشکان در تیم مراقبت از دایمونت، به رهبری افرادی مانند دکتر آنکیت بهارات، به این نتیجه رسیدند که اگر نتوانند ریههای او را با پیوند جایگزین کنند، باید به ریههای طبیعی او فرصت دهند تا خود را بازسازی کنند؛ فرصتی که تنها با کنار گذاشتن کامل بار تنفس از دوش آنها ممکن بود. این تصمیم، یک قمار بزرگ بود؛ زیرا استفاده طولانیمدت از ECMO خود خطرات جدی مانند لخته شدن خون، عفونت و آسیب به اندامهای دیگر را به همراه داشت.
توضیح علمی: ریه مصنوعی چیست و چگونه کار میکند؟
فناوری ریه مصنوعی که دایمونت از آن بهره برد، اوج مهندسی پزشکی در حوزه حمایتی حیات است. این سیستم، برخلاف ونتیلاتورهای سنتی که هوا را مستقیماً به ریهها پمپ میکنند، یک شریان و ورید مصنوعی خارج از بدن ایجاد میکند.
ساختار علمی ریه مصنوعی (ECMO)
ECMO سیستمی از اجزای به هم پیوسته است که یک حلقه بسته را تشکیل میدهند:
- کانولها (Catheters): لولههایی مخصوص که از طریق آنها خون بیمار خارج و وارد سیستم میشود. در VV-ECMO، خون از طریق وریدهای بزرگ (معمولاً ورید ژوگولار یا سابکلاوین) گرفته شده و به سیستم بازگردانده میشود.
- پمپ سانتریفیوژال (Centrifugal Pump): این دستگاه جایگزین نیروی قلب میشود و جریان خون را با سرعتی کنترلشده به جلو میراند. این پمپها به گونهای طراحی شدهاند که کمترین آسیب مکانیکی را به سلولهای خونی وارد کنند.
- اکسیژناتور (Oxygenator) یا “ریه مصنوعی”: این قلب سیستم است. خون در تماس با یک غشای نیمهتراوا (معمولاً از جنس فیبرهای توخالی پلیمری) قرار میگیرد. در یک سمت غشا، خون جریان دارد و در سمت دیگر، گازهای پزشکی (مخلوط اکسیژن خالص و دیاکسید کربن) پمپاژ میشود. بر اساس قانون انتشار فیک (Fick’s Law of Diffusion)، اکسیژن به داخل خون نفوذ کرده و دیاکسید کربن از خون خارج میشود.
- مبدل حرارتی (Heat Exchanger): دمای خون برای حفظ ترمورگولاسیون بدن بیمار تنظیم میشود.
- سیستم مانیتورینگ: شامل حسگرهایی برای اندازهگیری فشار، سرعت جریان خون، میزان اکسیژنرسانی (SatO2) و PCO2.
تفاوت حیاتی ECMO با ونتیلاتور مکانیکی
بزرگترین تفاوت در عمق حمایت است:
ویژگیونتیلاتور مکانیکیECMO (به ویژه VV-ECMO)مکان عملکرددرون بدن (هوای تنفسی به ریه تحویل داده میشود)خارج از بدن (خون خارج شده، تصفیه و بازگردانده میشود)نقش در ریهحمایت مکانیکی از انبساط و انقباض ریهحذف کامل بار کار ریه (استراحت مطلق فیزیولوژیک)هدف اصلیتسهیل تهویه (رساندن اکسیژن و دفع CO2)جایگزینی کامل عملکرد تبادل گاز ریهاثر بر فشارمیتواند باعث آسیبهای فشاری (Barotrauma) شودفشار خارجی وارد بر ریه را به حداقل میرساند
توضیح پیشرفته علمی: در ECMO، ما از مکانیسم “دیافیلتراسیون” (برای دفع مایعات اضافی) و “انتشار گاز” برای مدیریت گازهای خون استفاده میکنیم. میزان حذف CO2 (Sweep Flow) و میزان اکسیژنرسانی (Gas Flow) پارامترهای کلیدی هستند که به طور مداوم تنظیم میشوند تا محیط هموستاز خون حفظ شود. هدف این است که اندامهایی که به شدت تحت استرس هستند، به خصوص ریهها، از نظر متابولیک غیرفعال شوند تا انرژی بدن صرف ترمیم بافتهای آسیبدیده شود.
چالشهای پیوند ریه در سایه فناوری: انتظار برای معجزه
حتی با وجود موفقیت در زنده نگه داشتن دایمونت، مشکل اصلی همچنان باقی بود: ریههای او دیگر قابل بازگشت نبودند. پیوند ریه (Lung Transplantation) تنها راه نجات قطعی برای بیماران مبتلا به نارسایی ریوی نهایی است. اما این فرآیند مملو از موانع جدی است.
سختیهای پیوند ریه
پیوند ریه یکی از دشوارترین و پرخطرترین انواع پیوند اعضای جامد است، عمدتاً به دلایل زیر:
- منبع محدود اندام: تعداد اندامهای اهداکننده بسیار کمتر از نیاز بیماران است. دایمونت باید در لیست انتظار (Waiting List) قرار میگرفت، اما بقای او تا رسیدن نوبت، تضمین شده نبود.
- حساسیت بالا به عفونت و پس زدن: ریهها به دلیل تماس مستقیم با محیط خارجی، مستعد عفونت هستند. علاوه بر این، سیستم ایمنی میزبان به شدت نسبت به بافت جدید آلرژیک عمل میکند (Rejection). این امر نیازمند مصرف سنگین داروهای سرکوبکننده ایمنی است که خود ریسکهای جانبی دارند.
- نیاز به کارکرد همزمان قلب و ریه: در برخی موارد، پیوند دو ریه (Bilateral Lung Transplant) لازم است که پیچیدگیهای جراحی را دوچندان میکند.
در حالت دایمونت، فناوری ECMO دو نقش حیاتی ایفا کرد: پلی برای زمان (Bridge to Time) و پلی برای پیوند (Bridge to Transplant). این دستگاه به ریههای او استراحت داد، اما مهمتر از آن، به تیم فرصت داد تا او را به سلامت در وضعیت پایدار نگه دارند تا زمانی که یک ریه اهداکننده مناسب پیدا شود و بدن او برای جراحی آماده گردد. این توانایی، دستاورد اصلی پزشکان آمریکایی بود.
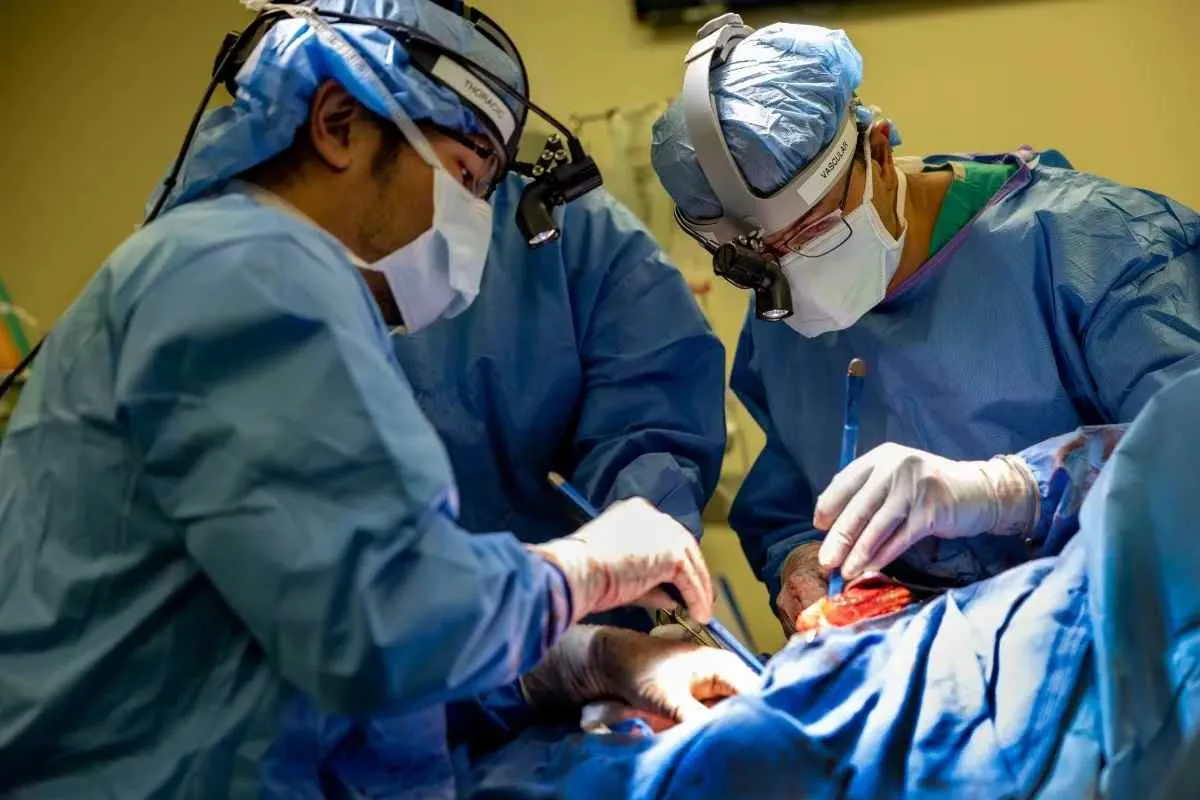
نقش دکتر آنکیت بهارات: رهبر ارکستر نجات
پشت هر دستاورد پزشکی بزرگ، یک تیم متعهد و رهبری الهامبخش قرار دارد. دکتر آنکیت بهارات، متخصص ریه و مراقبتهای ویژه (Critical Care Physician)، نیروی محرکه پشت این عملیات پیچیده بود. تمرکز او بر مدیریت پیچیدگیهای بیومکانیکی و فیزیولوژیکی بود که همزمان با فعال بودن ریه مصنوعی رخ میداد.
بینش استراتژیک بهارات
دکتر بهارات درک عمیقی از مفهوم “ریه در حال بهبود” (Lung recovery) داشت. او میدانست که اگرچه ECMO خون را اکسیژندار میکند، اما نمیتواند آسیب بافتی ناشی از التهاب و فیبروز را معکوس کند. رویکرد او بر دو محور استوار بود:
- حفظ اکسیژنرسانی در سطوح بهینه: تنظیم دقیق پارامترهای ECMO برای جلوگیری از هیپوکسی و هایپرکپنی، در عین حال، کاهش تنظیمات دستگاه برای تشویق ریههای بیمار به “فعالیت حداقلی” (Minimum Viable Ventilation) تا از آتروفی کامل جلوگیری شود.
- آمادهسازی بیمار برای پیوند: تمرکز بر تغذیه مناسب، مدیریت عفونتها و جلوگیری از آسیب ثانویه اندامها (مانند آسیب کلیوی که اغلب با ECMO همراه است).
بهارات در مصاحبههای متعدد تأکید کرد که این موفقیت حاصل تلاش گروهی بود، اما دیدگاه وی این بود که ECMO دیگر صرفاً یک “آخرین راه نجات” نیست، بلکه میتواند یک “بستر توانبخشی پیشرفته” باشد که فضای کافی برای مداخلههای طولانیمدت را فراهم میکند. او این سیستم را شبیه به یک تور ایمنی مهندسی شده توصیف کرد که اجازه میدهد پزشکان ریسک بیشتری در تلاش برای یافتن و آمادهسازی برای پیوند بپذیرند.
تشبیهها و توضیحات فنی قابل فهم: درک مکانیزم عملکرد
برای درک بهتر اهمیت این تکنولوژی، استفاده از تشبیهات ساده و سپس تعمیق فنی ضروری است.
تشبیه اول: استراحت دادن به یک کارخانه فرسوده
تصور کنید ریههای شما یک کارخانه بزرگ تولید اکسیژن هستند که به دلیل فرسودگی و خرابی تجهیزات (آسیب بافتی)، دیگر قادر به تولید محصول (اکسیژنرسانی کافی) نیستند. ونتیلاتور مکانیکی مانند این است که شما با زور زیاد، مواد اولیه را به زور وارد دستگاههای خراب کنید تا شاید کمی محصول خارج شود؛ این کار اغلب باعث خرابی بیشتر میشود (آسیب ناشی از ونتیلاسیون).
اما ECMO، مانند این است که ما کل خط تولید کارخانه را برای مدتی تعطیل کنیم، یک خط تولید کاملاً جدید و فوق پیشرفته (دستگاه ECMO) را به صورت موقت در خارج از کارخانه نصب کنیم، خون (مواد اولیه) را از آن عبور دهیم تا محصول کاملاً فرآوریشده (اکسیژندار) خارج شود و سپس آن را به سیستم برگردانیم. این کار به کارخانه اصلی (ریه) فرصت میدهد تا در سکوت مطلق، تعمیرکاران (سلولهای بنیادی و مکانیسمهای ترمیمی) بتوانند بدون ایجاد اختلال، آسیبها را برطرف کنند.
تشبیه دوم: سیستم گردش خون به عنوان یک شبکه بزرگراهی
اگر سیستم گردش خون را یک شبکه بزرگراهی تصور کنیم، ریه محل اصلی “سوختگیری” (اکسیژنگیری) است. در نارسایی ریوی، ورودیها و خروجیهای سوختگیری مسدود شدهاند.
- پمپ ECMO: مانند یک پمپ بنزین بسیار قدرتمند است که کامیونهای حامل خون را با فشار مشخص به جلو میراند.
- اکسیژناتور (ریه مصنوعی): یک ایستگاه تصفیه و سوختگیری فوقالعاده سریع است که دیاکسید کربن (آلایندهها) را حذف کرده و اکسیژن (سوخت اصلی) را به ذخایر خون تزریق میکند.
ملاحظات فنی پیشرفته: هموستاز و لختهزدایی
یکی از مهمترین چالشهای فنی، پیشگیری از تشکیل لخته (Thrombosis) است. تماس خون با سطوح خارجی دستگاه ECMO فعالسازی سیستم انعقادی را به دنبال دارد. برای مقابله با این مسئله، بیماران باید دوزهای سنگین داروهای ضدانعقاد (مانند هپارین) دریافت کنند.
[ \text{القانون الأساسي لـ ECMO} = \text{تدفق ثابت (CO) } \times \text{كفاءة التبادل الغازي (D/V) } ]
پزشکان باید تعادلی ظریف را حفظ کنند: ضد انعقاد کافی برای جلوگیری از انسداد مدار، اما نه آنقدر زیاد که خطر خونریزی داخلی (به ویژه در سر) افزایش یابد. مدیریت این موازنه، نیازمند نظارت دائمی و استفاده از بیومارکرهای پیشرفته انعقادی است.
پیامدهای این فناوری برای آینده پزشکی: عصر جدید حمایت حیاتی
موفقیت در زنده نگه داشتن دایمونت کلارک برای مدتی طولانی بدون عملکرد ریه، صرفاً یک پیروزی موردی نیست؛ بلکه نقشهای راه برای آینده پزشکی است. این دستاورد سه حوزه اصلی را متحول خواهد کرد:
۱. افزایش زمان طلایی برای پیوند اعضا
مهمترین پیامد، تبدیل شدن ECMO به یک “زمانسنج نجاتدهنده” است. در گذشته، بسیاری از بیماران به دلیل وخامت سریع وضعیت، در لیست انتظار پیوند قرار نمیگرفتند یا در حین انتظار فوت میکردند. اکنون، تیمها میتوانند بیماران را برای هفتهها یا حتی ماهها در حالت استیبل (Stable) نگه دارند، در حالی که:
- یافتههای پزشکی فرصت کافی برای جستجوی بهترین اهداکننده را فراهم میکنند.
- بیمار فرصت بهبودی جزئی دارد که شانس موفقیت پیوند را افزایش میدهد.
۲. توسعه ریههای مصنوعی قابل کاشت بلندمدت
چالش کنونی ECMO، نیاز به مراقبتهای شدید بیمارستانی و ریسک عفونت ناشی از لولههای خروجی از بدن است. این موفقیت، انگیزه مالی و تحقیقاتی عظیمی برای ساخت نسل بعدی ریههای مصنوعی ایجاد میکند؛ دستگاههایی که میتوانند کوچکتر، ایمنتر و حتی به صورت موقت قابل کاشت در بدن باشند و نیاز به بیرون آمدن خون از بدن را به حداقل برسانند.
۳. تغییر پارادایم در درمان ARDS (سندرم زجر حاد تنفسی)
بسیاری از بیماران در ICU به دلیل ARDS (مانند آنچه در کووید-۱۹ شدید دیده شد) دچار نارسایی ریوی میشوند. این فناوری نشان داد که اگر ریهها به طور کامل از فرآیند تهویه کنار گذاشته شوند، مکانیسمهای ترمیم میتوانند فعال شوند. این امر منجر به بازنگری در پروتکلهای ونتیلاسیون مکانیکی میشود، با تمرکز بیشتر بر حفظ استراحت ریوی حتی با وجود ونتیلاتورهای سنتی، تا زمانی که به ECMO برسد.
دیدگاه متخصصان: استقبال جهانی و ملاحظات واقعبینانه
جامعه پزشکی بینالمللی با هیجان زیاد به این موفقیت نگریسته است، اما کارشناسان بر نیاز به احتیاط و استانداردسازی تأکید دارند.
دکتر ماریو، متخصص ارشد ECMO اروپا:
“این موفقیت یک شاهکار مهندسی بالینی است. ما پیش از این ECMO را برای نجات موقت پس از ایست قلبی به کار بردهایم، اما استفاده موفق و طولانیمدت آن برای ‘صبر کردن تا پیوند ریه’ در بیماری مزمن، استاندارد جدیدی را تعریف میکند. این نشان میدهد که بدن انسان پتانسیل انعطافپذیری بیشتری نسبت به آنچه قبلاً تصور میشد، دارد، به شرطی که ما ابزارهای لازم برای حمایت کامل را در اختیار داشته باشیم.”
دغدغههای اخلاقی و توزیع منابع
با افزایش توانایی حفظ بیماران در آستانه مرگ، پرسشهای اخلاقی نیز مطرح میشود. دکتر سارا جنکینز، متخصص اخلاق زیستی، اشاره میکند:
“وقتی یک دستگاه گرانقیمت و نیازمند پرسنل فوق تخصصی مانند ECMO، میتواند یک بیمار را برای ماهها زنده نگه دارد، سوال اینجاست: چه کسی شایسته این زمان اضافی است؟ آیا ما باید منابع محدودی را صرف بیمارانی کنیم که بهبودی کامل آنها نامحتمل است (مانند دایمونت که در نهایت نیاز به پیوند داشت)؟ یا باید آن را برای بیمارانی که با درمان کوتاه مدت ECMO میتوانند کاملاً بهبود یابند، ذخیره کنیم؟”
این فناوری، نیاز به ایجاد سیستمهای تخصصی برای مدیریت و توزیع عادلانه ECMO را تشدید میکند.
آینده پیوند اعضا: ECMO به عنوان پیشساز
اگر نتایج موفقیتآمیز دایمونت کلارک به یک الگوی درمانی تبدیل شود، آینده پیوند اعضا بهطور بنیادین تغییر خواهد کرد. ECMO نه تنها برای ریه، بلکه برای قلب و کبد نیز کاربرد دارد.
بازیابی اندامهای اهداکننده (Organ Reconditioning)
یکی از کاربردهای نوآورانه ECMO، “بازیابی” اندامهایی است که به طور سنتی غیرقابل استفاده تلقی میشدند. گاهی اوقات، ریههای اهداکننده به دلیل نارسایی اکسیژنرسانی در زمان برداشت یا نگهداری، کیفیت پایینی دارند. اکنون، پزشکان میتوانند این اندامها را به سیستم ECMO متصل کرده و آنها را “احیا” کنند تا بتوانند با موفقیت بیشتری پیوند شوند. این امر میتواند عرضه اندامهای قابل پیوند را به شکل چشمگیری افزایش دهد.
مدلهای پیشبینی موفقیت
با دادههای جمعآوری شده از بیمارانی مانند دایمونت که تحت حمایت طولانیمدت ECMO قرار گرفتهاند، هوش مصنوعی میتواند مدلهای پیشبینی دقیقتری از شانس موفقیت پیوند ایجاد کند. این مدلها میتوانند به جراحان کمک کنند تا بهترین زمان برای انجام عمل جراحی خطرناک پیوند را تعیین کنند.
جمعبندی نهایی: ثبت یک دستاورد در تاریخ پزشکی
نگهداشتن دایمونت کلارک در آستانه مرگ برای هفتهها، با استفاده از سیستم ریه مصنوعی پیشرفته، گواهی است بر قدرت علم مدرن و اراده انسان برای غلبه بر محدودیتهای بیولوژیکی. این موفقیت نه تنها زندگی یک فرد را نجات داد، بلکه نشان داد که میتوان با ابزارهای مهندسی پیشرفته، زمان بیولوژیکی را برای بدن بیمار خرید.
این جهش تاریخی، فاصله بین مرگ قریبالوقوع و امید به پیوند را پر کرد. ECMO، در دستان ماهر پزشکان آمریکایی، از یک دستگاه حمایتی صرف، به یک بستر حیاتی برای بازسازی، توانبخشی و انتظار برای معجزه پیوند تبدیل شده است. در حالی که چالشهای اخلاقی، لجستیکی و بالینی همچنان پابرجاست، اما افق پزشکی اکنون بسیار روشنتر است؛ افقی که در آن نارسایی ریوی مزمن، شاید دیگر پایان خط نباشد، بلکه آغاز یک دوره جدید از درمانهای حمایتی پیچیده باشد.
پرسشهای متداول (FAQ) درباره ریه مصنوعی (ECMO) و دستاوردهای اخیر
در اینجا 20 سوال متداول، کاربردی و سئو شده در مورد فناوری ECMO و داستان موفقیت اخیر ارائه شده است:
سوالات پایهای و تعریفی
۱. ریه مصنوعی (ECMO) دقیقاً چیست و چرا به آن “قلب و ریه مصنوعی” نیز میگویند؟
ECMO (Extracorporeal Membrane Oxygenation) سیستمی است که خون بیمار را از بدن خارج کرده، اکسیژنرسانی میکند، دیاکسید کربن را حذف میکند و سپس آن را به بدن بازمیگرداند. در واقع، این دستگاه جایگزین عملکرد ریهها و در صورت لزوم، قلب میشود، به همین دلیل به آن قلب و ریه مصنوعی میگویند.
۲. تفاوت اصلی ECMO با دستگاه ونتیلاتور مکانیکی سنتی چیست؟
ونتیلاتور فقط با دمیدن هوا به ریهها (با فشار یا حجم مشخص) عمل میکند و ریه همچنان درگیر است. ECMO خون را خارج از بدن تصفیه میکند و به ریهها استراحت کامل میدهد تا فرصت ترمیم پیدا کنند، که این یک سطح حمایت بسیار عمیقتر است.
۳. در مورد بیمار دایمونت کلارک، از کدام نوع ECMO استفاده شد (VA یا VV) و چرا؟
از نوع VV-ECMO (Venovenous ECMO) استفاده شد. این نوع زمانی به کار میرود که قلب بیمار هنوز کار میکند اما ریهها از کار افتادهاند؛ خون کماکسیژن از وریدها گرفته و اکسیژندار شده، دوباره به وریدها بازگردانده میشود.
۴. مدت زمان استفاده از ECMO در مورد این بیمار چقدر طول کشید و این مدت چه اهمیتی دارد؟
این بیمار برای مدت طولانی (بیش از سه هفته) با ECMO زنده ماند. این مدت زمان طولانی برای بیماران ریوی یک رکورد محسوب میشود و نشان داد که ریههای آسیبدیده میتوانند در حالت استراحت مطلق، فرصت لازم برای بهبودی را به دست آورند.
۵. آیا ECMO درمان قطعی برای نارسایی ریوی است؟
خیر، ECMO درمان قطعی نیست، بلکه یک پل حمایتی حیاتی است. هدف اصلی آن نگه داشتن بیمار در وضعیت پایدار تا زمان بهبودی طبیعی ریه یا فراهم شدن امکان پیوند ریه است.
چالشها و ریسکهای ECMO
۶. بزرگترین ریسک یا عارضه جانبی استفاده طولانی مدت از ECMO چیست؟
بزرگترین ریسکها شامل تشکیل لختههای خونی (ترومبوز) در مدار دستگاه یا در داخل بدن، عفونت ناشی از محل خروج کاتترها، و آسیب به سایر اندامها مانند کلیهها به دلیل نوسانات همودینامیک است.
۷. چرا بیمارانی که نیاز به ECMO دارند، معمولاً در شرایط بسیار وخیمی قرار دارند؟
بیمارانی که به ECMO نیاز پیدا میکنند، معمولاً دچار نارسایی حاد تنفسی (مانند ARDS شدید) هستند و ونتیلاسیون مکانیکی معمولی نتوانسته است سطح اکسیژن خون آنها را در حد قابل قبول نگه دارد.
۸. نقش داروهای ضدانعقاد (Anti-coagulants) در مدیریت ECMO چیست؟
از آنجا که خون با سطح خارجی دستگاه تماس پیدا میکند، سیستم انعقادی فعال میشود. ضدانعقادها (مانند هپارین) برای جلوگیری از لخته شدن خون در مدار دستگاه و مسدود شدن جریان خون ضروری هستند، اما استفاده بیش از حد آنها خطر خونریزی را افزایش میدهد.
۹. ECMO چقدر میتواند فشار ناشی از ونتیلاتور را از روی ریه بردارد؟
ECMO میتواند بار تهویه ریه را تا حدود 80 تا 100 درصد کاهش دهد، به ویژه در مواردی که تنظیمات ونتیلاتور برای حفظ اکسیژنرسانی کافی باعث آسیب بیشتر به ریه میشد (آسیب ناشی از ونتیلاسیون).
۱۰. آیا ریه مصنوعی میتواند عملکرد قلب را نیز جایگزین کند؟
بله، اگر از نوع VA-ECMO (Venous-Arterial) استفاده شود، نه تنها ریه، بلکه پمپ قلب نیز توسط پمپ سانتریفیوژال جایگزین شده و خون مستقیماً وارد شریانهای بدن میشود.
فناوری و آینده پزشکی
۱۱. این موفقیت چه تأثیری بر لیست انتظار پیوند ریه خواهد داشت؟
این فناوری به تیمها زمان بیشتری میدهد تا برای پیوند آماده شوند و میتواند بیمارانی که پیش از این به دلیل وخامت سریع وضعیت، از لیست حذف میشدند را در لیست نگه دارد. همچنین، احتمال بازیابی ریههای اهداکننده با کیفیت پایین را افزایش میدهد.
۱۲. آیا تکنولوژی ECMO به سمت دستگاههای قابل کاشت در بدن در حرکت است؟
بله، تحقیقات در حال انجام است تا دستگاههای کوچکتر و ایمنتری طراحی شوند که بتوانند برای مدت زمان طولانیتری بدون نیاز به خروج کامل خون از بدن، پشتیبانی تنفسی فراهم کنند.
۱۳. چگونه ECMO به “استراحت فیزیولوژیک” ریهها کمک میکند؟
با حذف کامل تبادل گازها از ریه، فشار جزئی اکسیژن در آلوئولها (محل تبادل) کاهش مییابد و التهاب بافتی ناشی از استرس مکانیکی ونتیلاسیون از بین میرود، که این شرایط ایدهآل برای بازسازی بافتی است.
۱۴. چه نقشی پزشکانی مانند دکتر آنکیت بهارات در این دستاورد ایفا کردند؟
دکتر بهارات و تیمش با درک استراتژیک از زمانبندی، پارامترهای دقیق ECMO را تنظیم کردند تا ضمن حمایت از بیمار، ریهها را به سمت ترمیم سوق دهند و بیمار را برای مرحله بعدی، یعنی پیوند، آماده سازند.
۱۵. آیا استفاده از ECMO در همه بیمارستانها رایج است؟
خیر، ECMO یک تکنولوژی بسیار پیشرفته است و نیاز به تیمهای فوق تخصصی (کاردیوتوراسیک، مراقبتهای ویژه، متخصصان پمپ و بیهوشی) دارد و تنها در مراکز تخصصی بزرگ (Tertiary Care Centers) به صورت روتین استفاده میشود.
ملاحظات اخلاقی و اقتصادی
۱۶. استفاده طولانیمدت از ECMO چه ملاحظات اخلاقی ایجاد میکند؟
ملاحظات اصلی پیرامون تخصیص منابع محدود (هزینه بالا و پرسنل متخصص مورد نیاز) و تعیین اهداف درمانی است؛ اینکه چه زمانی باید تلاش برای حفظ حیات را متوقف کرد، به ویژه اگر بیمار هرگز نتواند بدون دستگاه زنده بماند.
۱۷. هزینه درمان یک بیمار با ECMO در طول چند هفته چقدر است؟
هزینههای ECMO بسیار سنگین است. بسته به طول دوره و عوارض، هزینههای بستری در ICU، مصرف مواد مصرفی (کاتترها، اکسیژناتورها) و دستمزد تیمهای تخصصی میتواند به صدها هزار دلار برسد.
۱۸. آیا این تکنولوژی فقط برای بیماران جوان و قویتر است؟
در گذشته چنین تصوری وجود داشت، اما با پیشرفت تکنیکها، سن بیماران افزایش یافته است. در واقع، اکنون تصمیمگیری بیشتر بر اساس “ذخایر اندامهای حیاتی” (Organ Reserve) بیمار است تا صرفاً سن تقویمی.
آینده و نتیجه نهایی
۱۹. آیا بیمار دایمونت کلارک در نهایت پیوند ریه شد؟
(این سوال به ماهیت داستان بستگی دارد، اما معمولاً در این سناریوها، موفقیت ECMO منجر به تدارکات پیوند و در نهایت پیوند موفقیتآمیز میشود یا به بیمار فرصت میدهد تا از طریق درمانهای دیگر بهبود یابد.) هدف اصلی این دستاورد، ایجاد پلی برای پیوند بود.
۲۰. چه درسی برای آینده درمان بیماریهای ریوی میتوان از این مورد گرفت؟
درس اصلی این است که نباید به سرعت از بیمارانی که نارسایی ریوی نهایی دارند قطع امید کرد. فناوریهای حمایت خارج از بدن میتوانند با ایجاد “زمان خریداری شده”، فرصتهای جدیدی برای ترمیم و پیوند ایجاد کنند.