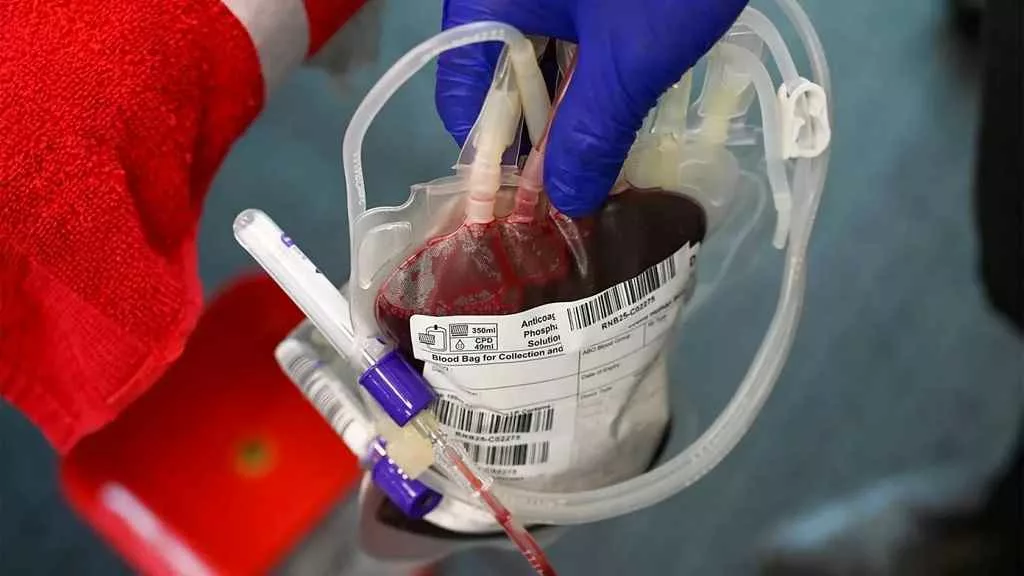
راز خون طلایی فاش شد؛ فقط ۵۰ نفر در جهان صاحب نادرترین گروه خونی Rh‑null هستند!
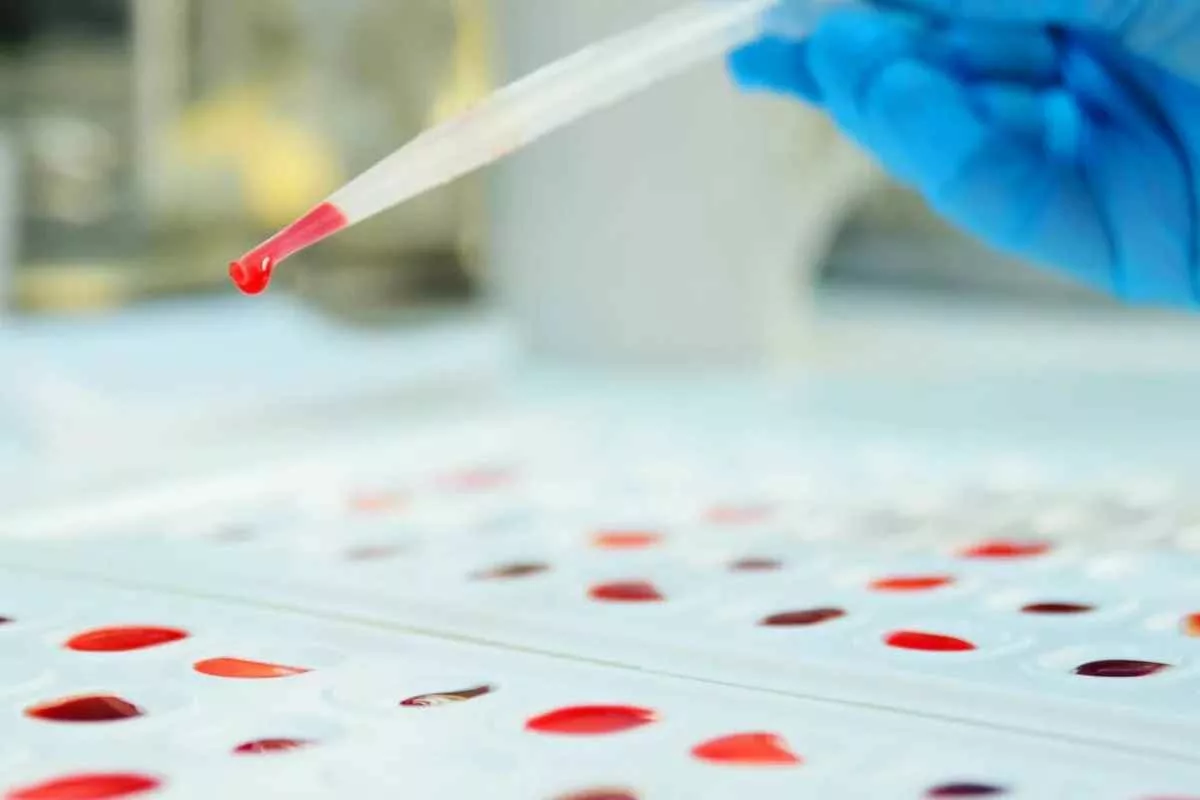
راز خون طلایی انسان؛ تنها ۵۰ نفر صاحب نادرترین گروه خونی Rh‑null
نجات جانها و رازهای سلولی
انتقال خون یکی از بزرگترین دستاوردهای پزشکی مدرن است؛ مفهومی ساده که جان میلیونها انسان را در سراسر جهان نجات داده است. اما در پس این فرایند نجاتبخش، دنیایی پیچیده از آنتیژنها، تطابقهای سلولی و رازهای ژنتیکی وجود دارد که کشف آنها مرز میان بقا و خطر را تعیین میکند. در این میان، گروه خونی «Rh‑null» ــ یا همان «خون طلایی» ــ رمزآلودترین و نادرترین نوع خون در جهان است؛ خونی که تاکنون تنها در ۵۰ انسان شناختهشده یافت شده و ارزش آن در پزشکی، همانند طلا در اقتصاد است.
بخش اول: انتقال خون و مفهوم نادر بودن
انتقال خون، پلی میان مرگ و زندگی است؛ اما برای افرادی با گروه خونی بسیار نادر، یافتن نمونه سازگار تقریباً غیرممکن است. گروه خونی Rh‑null که فاقد هرگونه آنتیژن Rh است، از این نظر خاصترین نمونه محسوب میشود. در واقع، این نوع خون قادر است تقریباً با تمام انواع گروههای خونی دیگر سازگار شود، اما صاحبان آن نمیتوانند از هیچ گروه خونی دیگری خون دریافت کنند؛ وضعیتی دوگانه و متناقض.
دانشمندان از دهه ۱۹۶۰، پس از نخستین کشف Rh‑null در یک زن استرالیایی، این نوع خون را بهعنوان یکی از بزرگترین معماهای ایمونولوژی مطرح کردند. از آن زمان تا امروز، تنها حدود ۵۰ انسان با این گروه خونی شناسایی شدهاند که اغلب در بانکهای مخصوص خون نادر، خون خود را منجمد کردهاند تا در مواقع اضطراری از آن استفاده شود.
نادر بودن در آمار جهانی:
تخمین زده میشود که احتمال تولد فردی با گروه خونی Rh‑null تقریباً ۱ در ۶ میلیون نفر باشد. این نادر بودن فوقالعاده، نه تنها بر مراقبتهای پزشکی، بلکه بر مطالعه ژنتیک انسانی نیز تأثیر عمیقی گذاشته است. بانکهای خون نادر در سراسر جهان (مانند بانک خون صلیب سرخ بینالمللی) بهشدت در تلاشند تا نمونههای ذخیرهشده این افراد را حفظ کنند، چرا که در مواقع اورژانسی، این افراد تنها میتوانند از ذخیره خون خود استفاده کنند.
بخش دوم: سیستمهای گروهبندی خون و پیچیدگی نهفته
شناخت گروههای خونی بر اساس وجود یا نبود آنتیژنها روی سطح گلبولهای قرمز انجام میشود. این آنتیژنها، شامل پروتئینها و قندهایی هستند که سیستم ایمنی بدن میتواند آنها را شناسایی کند. اگر خون اهدایی حاوی آنتیژنهایی باشد که گیرنده فاقد آنهاست، سیستم ایمنی آن را تهدید تلقی کرده و واکنش شدید نشان میدهد.
سیستمهای ABO و Rh مهمترین تقسیمبندیها در طبقهبندی خونی هستند، اما این تنها بخشی از ماجراست. تا اکتبر ۲۰۲۴، بیش از ۴۷ گروه خونی و ۳۶۶ نوع آنتیژن مختلف توسط دانشمندان شناسایی شده است؛ رقمی چشمگیر که نشان میدهد سازگاری کامل میان دو انسان تقریباً غیرممکن است. همین پیچیدگی دلیل دشواری یافتن خون کاملاً سازگار برای افراد نادر است.
سیستمهای اصلی گروهبندی خونی:
- سیستم ABO: بر اساس آنتیژنهای A و B.
- سیستم Rh (Rhesus): مهمترین عامل، آنتیژن D است (Rh مثبت یا منفی).
با این حال، در سطح مولکولی، چالش بسیار عمیقتر است. آنتیژنها به مجموعههایی به نام “فنوتیپ” تقسیم میشوند که هر کدام توسط ژنهای خاصی کدگذاری میشوند. اگر فردی جهشی داشته باشد که تمامی پروتئینهای یک سیستم خاص را حذف کند، آنگاه وارد قلمروی گروههای خونی «کمیاب» یا «نادر» میشود.
بخش سوم: راز سیستم Rh و تولد خون طلایی
سیستم Rh شامل بیش از ۵۰ نوع آنتیژن است. وقتی گفته میشود فردی Rh منفی است، در واقع فقط فاقد آنتیژن Rh(D) است، اما ممکن است سایر آنتیژنهای Rh را داشته باشد. در مقابل، کسانی که Rh‑null هستند هیچیک از این آنتیژنها را ندارند؛ گلبولهای قرمز آنها از این نشانگرهای پروتئینی کاملاً تهیاند.
در نتیجه، بدن این افراد اگر خونی حاوی حتی یکی از آنتیژنهای Rh دریافت کند، واکنش ایمنی شدیدی نشان میدهد. به عبارت دقیقتر، اگر فردی Rh‑null باشد و خونی با آنتیژن Rh-C، Rh-E یا هر آنتیژن دیگر Rh دریافت کند، آنتیبادیهای قوی علیه آنتیژنهای موجود در خون اهدایی تولید میکند که منجر به واکنش همولیتیک حاد میشود.
اما خون Rh‑null از آنجا که هیچ آنتیژنی ندارد، میتواند تقریباً برای هر فرد دارای Rh مثبت یا منفی قابلاستفاده باشد. به همین دلیل این خون، «خون جهانی» و «طلایی» لقب گرفته است. این قابلیت «اهدای عمومی» بینظیر است، اما در عین حال «دریافت محدود» یک نقص جبرانناپذیر برای فرد است.
مکانیسم مولکولی Rh-Null:
ریشه این وضعیت در ناحیه کروموزوم ۱ (قوم Rh) قرار دارد. ژن مسئول تولید پروتئینهای Rh، به خصوص پروتئینهای غشایی مهم، RHAG (Rh-associated glycoprotein) است. در افراد Rh‑null، جهشهایی در این ژن رخ داده است که منجر به از دست رفتن کامل عملکرد این پروتئین میشود. نبود RHAG مانع از بیان و جایگیری سایر پروتئینهای Rh (مانند D، C، E، c، e) در غشای گلبول قرمز میشود.
[ \text{جهش در ژن } RHAG \implies \text{نقص در پروتئین } RHAG \implies \text{عدم تشکیل پلتفرم برای سایر آنتیژنهای Rh} \implies \text{فنوتیپ } Rh\text{-null} ]
بخش چهارم: سازگاری گسترده و چالش استفاده
در شرایط بحرانی که گروه خونی بیمار ناشناخته است، استفاده از خون Rh‑null نوع O میتواند جان فرد را نجات دهد. این ترکیب بهندرت یافت میشود، اما از نظر علمی یکی از امنترین انواع خون برای انتقال اضطراری محسوب میشود، زیرا کمترین پتانسیل ایجاد واکنش ایمنی متقابل را دارد.
با این حال، صاحبان Rh‑null در شرایط بحرانی عملاً هیچ اهداکنندهای جز خودشان ندارند. بنابراین حفظ و ذخیرهی خونشان در بانکهای کرایوژنیک (خون منجمد شده در دمای $-۸۰$ درجه سانتیگراد یا پایینتر) ضروری است. این امر مستلزم جمعآوری منظم خون از خود فرد در طول عمر و نگهداری دقیق آن است.
دادههای ژنتیکی نشان میدهند Rh‑null حاصل جهشهایی در ژن RHAG است؛ ژنی که مسئول تولید گلیکوپروتئین وابسته به Rh در گلبولهای قرمز است. این جهش باعث اختلال در تشکیل پروتئینهای دیگر Rh میشود و در نتیجه، هیچکدام از آنتیژنهای Rh شکل نمیگیرند. چنین جهشی نادر و اغلب ارثی است، اما گاهی هم بهصورت جهش نوظهور (De Novo Mutation) در نسلها مشاهده میشود.
وضعیت نگهداری:
نگهداری خون Rh‑null نیاز به یک زنجیره سرد پیچیده دارد. این خونها باید در شرایطی نگهداری شوند که از تشکیل کریستالهای یخ که میتواند ساختار سلولی را تخریب کند، جلوگیری شود. استفاده از مواد محافظ مانند گلیسرول در غلظتهای بالا و انجماد در نیتروژن مایع (حدود $-۱۹۶$ درجه سانتیگراد) روش استاندارد برای ذخیره بلندمدت است.
بخش پنجم: خون طلایی در آزمایشگاهها — از رؤیا تا واقعیت
در سال ۲۰۱۸، گروهی از محققان دانشگاه بریستول به سرپرستی دکتر «اش توی» توانستند خون Rh‑null را در آزمایشگاه بازسازی کنند. آنها از سلولهای نابالغ قرمز خون ویرایششده بهره بردند تا ژنهای مؤثر در پنج سیستم اصلی گروه خونی (ABO، Rh، Kell، Duffy و GPB) را حذف کنند.
به کمک فناوری CRISPR‑Cas9، این سلولها به گونهای مهندسی شدند که فاقد تمام آنتیژنهای شناختهشده باشند. این رویکرد، نه تنها Rh-null را هدف قرار میداد، بلکه تلاش میکرد تا خون «جهانی واقعی» یا Universal Red Blood Cell (URBC) را بسازد. نتیجه، سلولهای قرمز فوقسازگار بود؛ سلولهایی که توانستند با گروههای نادر مانند Rh‑null و گروه خونی بمبئی نیز تطابق نشان دهند. گروه بمبئی تنها در یک نفر از هر چهار میلیون نفر یافت میشود و مانند Rh‑null، از دریافت اکثر گروههای خونی محروم است.
موفقیت این پروژه راه را برای توسعهی «خون مصنوعی جهانی» هموار کرد؛ خونی که بتواند بدون نگرانی از ناسازگاری ایمنی، میان همه انسانها مبادله شود. این امر از طریق حذف آنتیژنهای کلیدی Rh و ABO انجام شد.
فرایند مهندسی:
فرایند شامل شناسایی و برش دقیق نواحی کدکننده آنتیژنهای A، B، D و سایر آنتیژنهای سطحی با استفاده از نوکلئازهای دقیق (مانند Cas9) بود. هدف، ایجاد یک سلول قرمز غیرفعال ایمنی (Immunologically Silent) است.
بخش ششم: چالشهای ویرایش ژن و مسائل اخلاقی
ویرایش ژن، اگرچه از منظر علمی شگفتانگیز است، اما در سطح جهانی هنوز با محدودیتهای فقهی و اخلاقی مواجه است. ساخت سلولهای خونی با ژنهای حذفشده مستلزم نظارت دقیق است، زیرا کوچکترین خطا میتواند به جهشهای ناخواسته و بیماریهای ژنتیکی منجر شود.
توی و همکارانش در شرکت نوپای Scarlet Therapeutics تلاش میکنند بدون استفاده از ویرایش ژن مستقیم در سلولهای بنیادی فرد، خون نادر را در محیط آزمایشگاه تولید کنند. آنها بانکهایی از نمونههای نادر، از جمله Rh‑null، ساختهاند تا از این نمونهها برای رشد گلبولهای قرمز خونی در شرایط کنترلشده استفاده کنند.
هدف نهایی این پژوهش ساخت «نسل بیپایان سلولهای قرمز» است؛ سیستمی که بتواند خون را در مقیاس صنعتی تولید و برای بیماران با گروههای نادر در دسترس قرار دهد. این روش، که مبتنی بر کشت سلولی (Cell Culture) است تا ویرایش ژن در سطح ژنوم انسانی، چالشهای اخلاقی کمتری را به همراه دارد.
ملاحظات ایمنی:
در هر تلاشی برای تولید خون مصنوعی، ایمنی سلول نهایی حیاتی است. سلولهای مهندسیشده باید هم از نظر قابلیت حمل اکسیژن (ظرفیت اکسیژنرسانی) و هم از نظر طول عمر در گردش خون، با سلولهای طبیعی رقابت کنند. علاوه بر این، باید اطمینان حاصل شود که هیچ بخش ویروسی یا ناخواستهای در طول فرایند تولید وارد محصول نهایی نشده باشد.
بخش هفتم: تلاشهای جهانی برای ساخت خون جهانی
در مؤسسه Versiti در میلواکی، تیمی به سرپرستی گریگوری دنوم در سال ۲۰۲۱ توانست با استفاده از سلولهای بنیادی پرتوان القایی (hiPSC) که از سلولهای پوستی یا خونی بالغ استخراج شدهاند، سلولهای قرمز Rh‑null را تولید کند. این سلولها از توانایی تبدیل به هر نوع سلول انسانی برخوردارند و برای ساخت خون نادر ابزار بینظیری محسوب میشوند.
در همان سال، پروژهای مشترک میان دانشگاه لاوال (کانادا) و دانشگاه بارسلونا آغاز شد. پژوهشگران سلولهای بنیادی خون A مثبت را گرفته و با کمک کریسپر، ژنهای A و Rh را حذف کردند تا سلولهایی از نوع O Rh‑null ایجاد کنند؛ نوعی خون آزمایشگاهی که میتواند در آینده بهعنوان ماده اولیه برای تولید انبوه خون همگانی مورد استفاده قرار گیرد.
این موفقیتها نشاندهنده جهش عظیم در بیولوژی سلولیاند اما مسیر تجاریسازی آنها بسیار دشوار است، زیرا هر قطره از چنین خون باید تحت استانداردهای ایمنی چندمرحلهای تائید شود، از جمله بررسی وجود باقیمانده کریسپر، اثربخشی انتقال اکسیژن، و تستهای حساسیتزایی.
مزیت استفاده از hiPSC:
استفاده از hiPSC این مزیت را دارد که میتوان خون را از سلولهای بنیادی خود بیمار (در صورت دسترسی) یا سلولهایی با سازگاری ژنتیکی بالا (ماسک کردن فنوتیپهای خطرناک) تولید کرد، و نگرانی بابت رد شدن توسط سیستم ایمنی میزبان را به حداقل رساند. این روش پتانسیل بالایی برای ساخت خون با سازگاری کامل دارد، حتی برای انواع خونی که از سیستمهای دیگر نیز نادر هستند.
بخش هشتم: چالش اصلی — بلوغ سلولها
بزرگترین مانع در ساخت خون مصنوعی، تبدیل سلولهای بنیادی به سلولهای قرمز بالغ و عملکردی است. در بدن، تکامل سلولهای قرمز (اریتروپوئزیس) در مغز استخوان طی فرآیندی دقیق و وابسته به صدها سیگنال مولکولی انجام میشود؛ بازسازی این پیچیدگی در آزمایشگاه تقریباً مانند شبیهسازی حیات در محیط مصنوعی است.
دنومه، مدیر امور پزشکی شرکت گریفولس، توضیح میدهد: «وقتی آنتیژنها حذف میشوند، گاهی غشای سلولهای قرمز ناپایدار میشود و سلول در محیط آزمایشگاهی نمیتواند به مرحله بلوغ برسد.» به بیان دیگر، حذف آنتیژنها اگرچه باعث سازگاری میشود، اما ممکن است ساختار مکانیکی سلول را دچار نقص کند. سلولهای بالغ RBC شکل دوکونقعر (Biconcave Disc) دارند که برای انعطافپذیری در مویرگهای باریک ضروری است.
از همین رو، بسیاری از مطالعات روی ترکیب فناوری ژنتیکی با زیستمواد سازگار (Biomaterials) تمرکز دارند تا بتوان محیطی فراهم کرد که سلولها در آن مشابه بدن رشد کنند، از جمله تنظیم دقیق غلظت اکسیژن، مواد مغذی و فاکتورهای رشد (مانند اریتروپویتین).
پایداری غشای سلولی:
پروتئینهای Rh، به ویژه RhAG، نقش مهمی در حفظ یکپارچگی ساختاری غشای سلول قرمز دارند. هنگامی که این پروتئینها حذف میشوند، غشا مستعد لیز شدن (همولیز) میشود، حتی اگر از لحاظ ایمنی «جهانی» باشند. محققان باید مطمئن شوند که سلولهای تولیدشده حداقل ۱۲۰ روز در بدن انسان دوام خواهند آورد، همانند سلولهای طبیعی.
بخش نهم: آزمایش بالینی RESTORE و گام نخست انسان
پروژه RESTORE که در بریتانیا آغاز شد، نخستین آزمایش رسمی انتقال خون مصنوعی به انسان بود. دکتر توی، یکی از سرپرستان پروژه، میگوید رسیدن به مرحله آزمایش انسانی بیش از ده سال پژوهش مداوم طول کشید. این پروژه با هدف تولید سلولهای قرمز مصنوعی با طول عمر مناسب انجام شد.
در این آزمایش، سلولهای قرمز تولید شده در آزمایشگاه بدون ویرایش ژنتیکی (بلکه با استفاده از سلولهای بنیادی خود فرد که به RBC تبدیل شده بودند) استفاده شدند تا ایمنی تزریق سنجیده شود. نتایج اولیه نشان داد که سلولهای مصنوعی قادرند در جریان خون انسان زنده بمانند و اکسیژن حمل کنند، بدون آنکه سیستم ایمنی واکنش منفی نشان دهد. اگرچه این خون کاملاً Rh-null نبود، اما گام بزرگی در اثبات مفهوم (Proof of Concept) برای ایمنی تزریق سلولهای تولیدشده خارج از بدن بود.
این پیشرفت، امید تازهای برای افرادی با گروههای فوقنادر مانند Rh‑null ایجاد کرده است؛ کسانی که پیش از این هیچ گزینه درمانی مطمئنی نداشتند. موفقیت RESTORE زمینه را برای تزریق سلولهای کاملاً مهندسیشده در آینده فراهم میکند.
مقایسه با روش بانک خون:
در روش سنتی، خون Rh-null از اهداکنندگان انسانی جمعآوری میشود که فرایندی پرهزینه، زمانبر و وابسته به سلامت آن فرد نادر است. در مقابل، روشهای مبتنی بر hiPSC پتانسیل تولید «نامحدود» سلولهای قرمز مهندسیشده را فراهم میآورند.
بخش دهم: فلسفه نادر بودن — از ژن تا معنا
خون طلایی شاید از دیدگاه علمی صرفاً یک پدیده ژنتیکی باشد، اما از منظر فلسفی، نماد یگانگی و پیچیدگی انسان است. طبیعت، با همه بینظمیاش، گاهی از دل آشوب، نظم خلق میکند؛ پدیدهای که در علم به «Order from Chaos» معروف است.
نادر بودن Rh‑null یادآور این حقیقت است که هر انسان حامل جهانی ژنتیکی منحصربهفرد است. در مقیاس زیستی، چنین نادر بودنی میتواند آغازگر نوآوری علمی باشد: از تولید خون جهانی تا درک بهتر از ژنتیک تکاملی بشر. تحلیل ژنوم این افراد، اطلاعات ارزشمندی درباره تکامل مسیرهای ایمنی و پروتئینی انسان فراهم میکند.
علمِ مدرن، در تلاش برای شبیهسازی این خون طلایی، در واقع در مسیر کشف سازوکار بنیادی حیات قدم برمیدارد. نیاز به Rh‑null در واقع محرکی برای توسعه تکنیکهایی بوده است که میتوانند در آینده برای درمان بیماریهای خونی مزمن مانند تالاسمی و کمخونی داسیشکل نیز استفاده شوند.
نتیجهگیری: امید جهانی از دل نادرترین خون
با وجود همه محدودیتها، چشمانداز آینده روشن است. تولید خون فوقسازگار، نهتنها برای بیماران Rh‑null بلکه برای میلیونها نفر که با ناسازگاریهای خونی مواجهاند، امید تازهای خواهد بود. فناوری کریسپر و سلولهای بنیادی در آستانه ایجاد تغییر بنیادین در صنعت انتقال خون هستند؛ شاید در دهه آینده، دیگر هیچ بیماری به دلیل نبود خون سازگار جان خود را از دست ندهد.
خون طلایی، ترکیبی از علم، ژنتیک و فلسفهی زیست است؛ معجونی از تصادفهای مولکولی که توان نجات همگان را دارد. این راز ۵۰ نفره، نقشه راهی را برای آینده پزشکی ترسیم کرده است.
🔻 سوالات متداول (FAQ)
۱. خون طلایی دقیقاً چیست؟
Rh‑null نوعی گروه خونی است که هیچکدام از ۵۰ آنتیژن سیستم Rh (شامل D، C، E، c، e و سایر زیرمجموعهها) را ندارد. این ویژگی منحصربهفرد آن را به نادرترین گروه خونی جهان تبدیل کرده است.
۲. چرا فقط حدود ۵۰ نفر این گروه خونی را دارند؟
زیرا جهش در ژن RHAG که مسئول بیان پروتئینهای Rh است، بسیار نادر است و اغلب بهصورت ارثی در خانوادههای خاص منتقل میشود که پیشینه ازدواج فامیلی یا ریشههای ژنتیکی محدود دارند.
۳. آیا صاحبان Rh‑null میتوانند خون O منفی دریافت کنند؟
خیر، حتی O منفی نیز برای آنها ناسازگار است. اگر خون O منفی حاوی هر یک از آنتیژنهای جانبی Rh باشد، سیستم ایمنی بدن آنها واکنش نشان میدهد؛ تنها خون Rh‑null قابل دریافت است.
۴. چرا به Rh‑null، خون طلایی میگویند؟
به دلیل سازگاری گسترده آن با سایر گروهها (قابل تزریق به اکثر بیماران) و ارزش پزشکی فوقالعاده بالای آن در مواقع اورژانسی که کمبود خونهای خاص وجود دارد.
۵. آیا میتوان Rh‑null را در آزمایشگاه تولید کرد؟
بله، با فناوری کریسپر و سلولهای بنیادی پرتوان القایی (hiPSC)، دانشمندان توانستهاند نسخههای آزمایشگاهی این نوع خون را تولید کنند و این مسیر برای تولید انبوه باز است.
۶. کدام کشورها پروژه ساخت خون طلایی را دنبال میکنند؟
بریتانیا (پروژه RESTORE)، آمریکا (مؤسسه Versiti)، کانادا و اسپانیا در خط مقدم پژوهش ساخت Rh‑null مصنوعی یا خون فوقسازگار قرار دارند.
۷. آیا خون طلایی برای عموم قابل خرید است؟
خیر، این خون فقط در بانکهای خون نادر و مراکز تحقیقاتی ذخیره میشود و برای افراد دارای این گروه خونی بهصورت رایگان در مواقع لزوم ذخیره میشود. ارزش آن در دسترس بودن است، نه قیمتگذاری تجاری.
۸. تولید انبوه خون مصنوعی چه زمانی ممکن میشود؟
پیشبینی میشود با تکامل فرایندهای زیستفناوری، تولید محدود بالینی خون کاملاً مهندسیشده و عاری از آنتیژن تا سال ۲۰۳۵ آغاز شود، اما تولید انبوه همچنان نیازمند گذراندن مراحل نظارتی طولانی است.
۹. آیا دستکاری ژنتیکی برای ساخت خون اخلاقی است؟
استفاده از ویرایش ژن در سلولهای بنیادی (نه ژنوم فرد زنده) برای اهداف درمانی، در اکثر کشورها تحت نظارت شدید اخلاقی انجام میشود و در صورت اثبات ایمنی، مجاز شمرده میشود.
۱۰. آینده گروه خون Rh‑null چیست؟
بهعنوان کلید ساخت خون جهانی و ابزار پژوهش در ژنتیک تکاملی انسان، Rh‑null در دهه آینده نقش محوری در توسعه درمانهای جایگزین برای بیماریهای خونی نادر ایفا خواهد کرد.