بازگشت مرگ خاموش؛ سویه فوقخطرناک حصبه در آستانه تسخیر جهان
شیوع جهانی سویه فوقخطرناک حصبه: بحران سلامت نوظهور در عصر مقاومت دارویی
در عصر پیشرفتهای چشمگیر پزشکی و غلبه بر بسیاری از عفونتهای باستانی، جهان با تهدیدی مواجه است که ماهیت بقای میکروبی را به شکلی بیسابقه به چالش میکشد: گسترش جهانی سویه فوقخطرناک (XDR) سالمونلا تایفی، عامل بیماری حصبه. این بیماری که زمانی به عنوان یادگاری از قرنهای گذشته و نمادی از فقر زیرساختی شناخته میشد، اکنون با مسلح شدن به مکانیسمهای پیچیده مقاومت دارویی، به یک بحران بهداشت جهانی تبدیل شده است. این سویه جدید، که به دلیل مقاومت در برابر چندین دسته از آنتیبیوتیکهای حیاتی شهرت یافته، توانایی ایجاد عفونتهای سرکش و درمانناپذیر را دارد. خبر خوب این است که پیشرفتهای اخیر در علم ژنتیک و اپیدمیولوژی، نقشهای دقیق از مسیرهای انتشار این قاتل خاموش ترسیم کرده است؛ اما خبر نگرانکننده این است که سرعت جهش و گسترش این میکروب، از توانایی ما در توسعه و توزیع درمانهای جدید سبقت گرفته است. این مقاله، کاوشی عمیق در ماهیت این تهدید، ریشههای تکاملی آن، پیامدهای جهانی، و استراتژیهای فوری مورد نیاز برای مهار این پاندمی خاموش خواهد بود. ما در آستانه یک نقطه عطف هستیم؛ جایی که بقای جمعیتهای آسیبپذیر وابسته به اقدام سریع و هماهنگی بینالمللی برای مهار “اَبَر میکروبی حصبه” است.
تهدید خاموش یک بیماری باستانی
بیماری حصبه (Typhoid Fever)، که توسط باکتری سالومونلا انتریکا سروتیپ تایفی (Salmonella enterica serovar Typhi) ایجاد میشود، قدمتی به اندازه تمدن بشری دارد. این بیماری عفونی گوارشی که از طریق مصرف آب یا غذای آلوده به مدفوع افراد بیمار منتقل میشود، قرنهاست که جوامع را با تبهای طولانیمدت، ضعف شدید، و در موارد عدم درمان، مرگ و میر بالا مواجه ساخته است. در گذشته، حصبه مترادف با فقر، تراکم جمعیتی بالا، و فقدان زیرساختهای بهداشتی مناسب بود. شهرهایی که فاقد سیستمهای تصفیه آب پیشرفته بودند، به طور مداوم قربانی موجهای این بیماری بودند.
با پیشرفت علم میکروبیولوژی در قرن بیستم، به ویژه کشف آنتیبیوتیکها، امیدواریهای بزرگی برای ریشهکنی این بیماری باستانی شکل گرفت. کلرامفنیکل، آمپیسیلین، و تریمتوپریم-سولفامتوکسازول برای دههها سنگرهای اصلی دفاعی در برابر عفونتهای سالمونلا تایفی بودند. این موفقیتها، به ویژه در کشورهای توسعهیافته، منجر به کاهش چشمگیر موارد حصبه شد و این تصور را تقویت کرد که این بیماری در حال تبدیل شدن به یک خاطره تاریخی است.
اما، تاریخ پزشکی مملو از داستانهایی است که نشان میدهد میکروبها هرگز تسلیم نمیشوند. آنها با سازگاریهای ژنتیکی حیرتانگیز، توانایی بالقوهای برای دور زدن دفاعیات شیمیایی بشر دارند. حصبه، با وجود ظاهر باستانیاش، نمونهای بارز از این انطباقپذیری است. بقای آن در محیطهای چالشبرانگیز شهری و روستایی، همراه با توانایی آن در پنهان شدن در بدن ناقلین مزمن، بستر مناسبی برای ظهور مقاومت دارویی فراهم کرد. آنچه امروز شاهد آن هستیم، نتیجه دهها سال فشار انتخابی ناشی از استفاده بیرویه و نادرست از آنتیبیوتیکها در سراسر جهان است؛ فشاری که منجر به تکامل یک سویه شده که تقریباً تمام خطوط دفاعی دارویی ما را به چالش میکشد و آن را به یک بحران بهداشت جهانی مدرن تبدیل کرده است.
سویههای مقاوم دارویی؛ چگونه حصبه در حال تبدیل شدن به یک ابرمیکروب است؟
مقاومت ضد میکروبی (Antimicrobial Resistance – AMR) پدیدهای طبیعی است، اما مقیاس و سرعت گسترش آن در دهههای اخیر نگرانکننده شده است. مقاومت دارویی در باکتری سالمونلا تایفی، به ویژه سویه XDR، صرفاً به ناتوانی در درمان محدود نمیشود؛ بلکه نشاندهنده یک شکست سیستمی در مدیریت منابع دارویی جهانی است.
تعریف سویه فوقخطرناک (XDR) حصبه
سویه فوقخطرناک (Extensively Drug-Resistant – XDR) حصبه به باکتری سالمونلا تایفی اطلاق میشود که نه تنها نسبت به آنتیبیوتیکهای نسل اول (مانند آمپیسیلین، کلرامفنیکل، و تریمتوپریم-سولفامتوکسازول) مقاوم است، بلکه در برابر فلوروکینولونها (مانند سیپروفلوکساسین) که برای سالها خط مقدم درمان بودند، نیز شکست خورده است. در تعریف دقیقتر، سویه XDR گونهای از باکتری است که نسبت به حداقل سه دسته از آنتیبیوتیکهای کلیدی مورد استفاده برای درمان آن، مقاومت نشان میدهد. در مورد سالمونلا تایفی، ظهور سویههای XDR در واقع به معنای محدود شدن شدید گزینههای درمانی مؤثر است. این میکروب توانسته است مکانیسمهای دفاعی خود را با جذب و انتقال ژنهای مقاومت (معمولاً از طریق پلاسمیدها یا ترانسپوزونها) تقویت کند.
توضیح جامع مقاومت ضد میکروبی (AMR)
AMR زمانی رخ میدهد که میکروبها در پاسخ به مواجهه مکرر با آنتیبیوتیکها، توانایی زنده ماندن در حضور آن داروها را کسب میکنند. این فرآیند اغلب از طریق جهشهای تصادفی در DNA باکتریایی یا، به طور نگرانکنندهتر، از طریق انتقال افقی ژنهای مقاومت (Horizontal Gene Transfer – HGT) انجام میشود. در مورد سالمونلا تایفی، این انتقال از طریق پلاسمیدها صورت میگیرد که امکان اشتراکگذاری سریع مجموعههای ژنی مقاومت را بین سویههای مختلف باکتری فراهم میآورد.
مکانیسمهای کلیدی مقاومت:
- تغییر در هدف آنزیمی: جهش در ژنهایی که هدف آنتیبیوتیک هستند، باعث میشود دارو دیگر نتواند به طور مؤثر به هدف خود متصل شود.
- فعالسازی پمپهای خروجی (Efflux Pumps): این پمپها مانند پمپهای فعال، آنتیبیوتیکها را به محض ورود به سلول باکتریایی، به بیرون از آن پمپاژ میکنند و غلظت داروی کشنده را در داخل سلول کاهش میدهند.
- تولید آنزیمهای غیرفعالکننده: این آنزیمها (مانند بتالاکتامازها) ساختار شیمیایی آنتیبیوتیک را تغییر داده و آن را بیاثر میسازند.
آمار جهانی AMR و جایگاه حصبه
سازمان بهداشت جهانی (WHO) مقاومت ضد میکروبی را یکی از ۱۰ تهدید بزرگ سلامت عمومی جهانی معرفی کرده است. در حالی که تمرکز زیادی بر روی گرم-منفیهای بیمارستانی مانند کلی یا سودوموناس وجود دارد، شیوع سویههای مقاوم حصبه یک هشدار جدی برای بیماریهای منتقله از طریق آب و غذا است. تخمین زده میشود که سالانه بیش از ۱.۲۷ میلیون مرگ در جهان مستقیماً به عفونتهای مقاوم به درمان نسبت داده میشود. ورود سالمونلا تایفی XDR به این فهرست، چالشهای پیشبینی نشدهای را بر حوزه کنترل بیماریهای عفونی تحمیل کرده است، زیرا این سویه نه تنها در محیطهای بیمارستانی بلکه در جوامع با زیرساختهای ضعیف نیز گسترش مییابد و سیستمهای نظارتی محلی را فلج میکند.
فراتر از آمارها؛ پشتپرده تکامل سویه XDR
درک عمق بحران XDR نیازمند نگاهی دقیقتر به مسیر تکاملی این پاتوژن است. تکامل سویههای مقاوم، یک رویداد ناگهانی نبود، بلکه یک فرایند تدریجی بود که با جمعآوری متوالی جهشها و انتقال پلاسمیدهای مقاومت، به اوج خود رسید.
نتایج پژوهش ژنومی ۲۰۱۴ تا ۲۰۱۹: نقشهبرداری از یک ابرمیکروب
در یک مطالعه محوری که بر نمونههای جمعآوری شده در فاصله سالهای ۲۰۱۴ تا ۲۰۱۹ تمرکز داشت، دانشمندان توانستند شجرهنامه دقیق سویههای مقاوم را ترسیم کنند. این پژوهشها بر روی هزاران ایزوله بالینی متمرکز شدند و از روشهای پیشرفته توالییابی ژنومی (Whole Genome Sequencing – WGS) برای شناسایی دقیق جهشها و عناصر ژنتیکی متحرک مسئول مقاومت استفاده کردند.
در طول این دوره، محققان به طور خاص بر روی افزایش فراوانی ایزولههایی متمرکز شدند که دیگر به نسلهای جدیدتر آنتیبیوتیکها نیز پاسخ نمیدادند. با توالییابی ۳۴۸۹ ایزوله، مشخص شد که سویههای مقاوم جدید از یک سویه مشترک منشأ گرفتهاند که اولین بار در منطقه سند پاکستان شناسایی شده بود. این تجزیه و تحلیل ژنومی نشان داد که مقاومتها به صورت متوالی انباشته شدهاند: ابتدا مقاومت به نسل اول داروها، سپس مقاومت به فلوروکینولونها (از طریق جهش در ژنهای gyrA و parC)، و نهایتاً اکتساب پلاسمیدهای مقاوم به آزیترومایسین، که آن را به وضعیت XDR رساند. این مطالعات ژنومی، نه تنها الگوهای مقاومت را مشخص کردند، بلکه مسیرهای مهاجرت میکروب را نیز با دقت بالایی بازسازی نمودند.
چگونه سویههای مقاوم، نمونههای غیرمقاوم را کنار میزنند
تکامل یک سویه مقاوم و تسلط آن بر جمعیتهای میکروبی، یک فرایند رقابتی است که توسط انتخاب طبیعی هدایت میشود. در محیطهایی که دسترسی به آنتیبیوتیکها بالا و متغیر است، سویههایی که جهشهای لازم برای بقا در حضور دارو را کسب کردهاند، مزیت بقا و تکثیر پیدا میکنند. این برتری در یک “فشار انتخابی” مداوم رخ میدهد.
وقتی یک فرد بیمار با آنتیبیوتیک درمان میشود، بخش بزرگی از باکتریهای حساس از بین میروند، اما تعداد کمی از باکتریهای مقاوم زنده میمانند. این بازماندگان، فضای خالی ایجاد شده را پر میکنند و تکثیر میشوند. در طول زمان، این امر منجر به جایگزینی جمعیتهای حساس با جمعیتهای مقاوم میشود. در زمینه حصبه XDR، این سویهها اغلب از نظر پاتوژنیسیته (توانایی ایجاد بیماری) با سویههای حساس تفاوتی ندارند، اما مزیت مطلق آنها در محیط درمانی است؛ جایی که درمانهای استاندارد شکست میخورند. این پدیده به عنوان “اَبَرمیکروبهای رقیب” شناخته میشود که به سرعت در حال بلعیدن جایگاههای اکولوژیکی در جوامع انسانی هستند.
نقش سفرهای بینالمللی و جابهجایی جمعیت
یکی از عوامل اصلی که یک بحران محلی را به یک بحران جهانی تبدیل میکند، جهانیشدن است. حصبه XDR به خوبی از مزایای شبکههای حمل و نقل مدرن بهره برده است. افرادی که در مناطق شیوع فعال مبتلا میشوند، اغلب بدون علامت یا با علائم خفیف، به دلیل کوتاهی دوره کمون و توانایی عفونی شدن قبل از بروز علائم شدید، به سفرهای بینالمللی میپردازند.
مسافرتهای تفریحی، زیارتی، و تجاری، به ویژه از مناطق درگیر به کشورهای با درآمد بالا (High-Income Countries – HICs) یا کشورهای دیگر در حال توسعه با زیرساختهای ضعیف، مسیرهای انتشار را فراهم میکنند. یک مسافر مبتلا میتواند در یک کشور امن، به دلیل ضعف در سیستمهای بهداشتی محلی، باعث ایجاد یک کانون جدید انتقال شود. از آنجایی که این سویه XDR است، تلاشهای اولیه برای تشخیص و درمان ممکن است به دلیل مقاومت پنهان، با شکست مواجه شود و به این ترتیب، انتقال طولانیتر و گستردهتر میشود. تحقیقات نشان دادهاند که بخش قابل توجهی از موارد اولیه XDR در اروپا و آمریکای شمالی، به مسافرانی مرتبط بوده که اخیراً از مناطق اندمیک بازدید کردهاند.
پاکستان؛ نقطه آغاز موج جهانی XDR
به طور قطعی، پاکستان، به ویژه منطقه سند، به عنوان مرکز اصلی تکامل و خروج سویه XDR سالمونلا تایفی شناخته میشود. این منطقه ترکیبی خطرناک از تراکم جمعیتی بالا، دسترسی محدود به آب آشامیدنی سالم و سابقهای طولانی در استفاده بیرویه از آنتیبیوتیکها را داراست.
شیوع داخلی تا ۲۰۱۹ و تبدیل به ژنوتیپ غالب
اولین موارد مقاوم به داروهای چندگانه (MDR) در پاکستان به اوایل دهه ۲۰۰۰ باز میگردد، اما جهش به سمت مقاومت گسترده (XDR) در سالهای اخیر شتاب گرفت. در سال ۲۰۱۶، اولین سویههایی که مقاومت چندگانه را نشان دادند، به طور رسمی شناسایی شدند. طی چند سال بعد، این سویهها به سرعت جایگزین سویههای حساستر شدند. در سال ۲۰۱۹، سویههای XDR به طور غالب در عفونتهای حصبه در پاکستان گزارش شدند. این تسلط نشاندهنده موفقیت انتخاب طبیعی در این منطقه است؛ سویه XDR در برابر کلینیکهای درمانی محلی که اغلب از آنتیبیوتیکهای ارزانتر و قدیمیتر استفاده میکردند، سربلند بیرون آمد.
بحران در پاکستان صرفاً یک مشکل بهداشتی نیست؛ بلکه یک شکست نظارتی است. کمبود واکسیناسیون روتین و مشکلات زیرساختی، به باکتری اجازه داد تا در یک محیط کشت وسیع، به جهشهای لازم برای کسب مقاومت در برابر فلوروکینولونها و سپس آزیترومایسین دست یابد.
مسیرهای انتشار بینالمللی به اروپا، آمریکا، آفریقا، جنوب شرق آسیا
پس از تثبیت در پاکستان، XDR شروع به نفوذ به سایر نقاط جهان کرد، اغلب از طریق انتقال انسان به انسان یا از طریق مسافران. این انتشار، ویژگیهای جغرافیایی متمایزی از خود نشان داده است:
- جنوب شرق آسیا: این منطقه به دلیل سفرهای مذهبی و تجاری گسترده، نقطه انتقال مهمی بوده است. برخی موارد شناسایی شده در کشورهای همسایه نشاندهنده نفوذ مستقیم یا مسافرتهای دورتر است.
- آفریقا: با وجود اینکه بار حصبه در آفریقا به طور سنتی بسیار بالاست، اما ورود سویه XDR به برخی مناطق این قاره، تهدید را تشدید کرده است، به ویژه در مناطقی که سیستمهای تشخیص و درمان آنتیبیوتیکی ضعیف هستند.
- اروپا و آمریکای شمالی: موارد وارداتی در این مناطق عمدتاً به مسافران بازگشته از پاکستان و مناطق مجاور مرتبط بوده است. هرچند در این کشورها، انتقال داخلی (community transmission) به دلیل زیرساختهای قوی آب و فاضلاب، بسیار نادر است، اما این موارد وارداتی، فشار زیادی بر سیستمهای نظارت دارویی و آزمایشگاهها وارد میکنند تا از گسترش محلی جلوگیری شود.
این الگوهای انتشار، اهمیت ردیابی ژنومی (Genomic Surveillance) را به عنوان یک ابزار حیاتی در خط مقدم مبارزه با AMR برجسته میسازند.
آخرین سنگر دارویی: آیا آزیترومایسین هم در حال سقوط است؟
هنگامی که سویههای حصبه به فلوروکینولونها مقاوم شدند، آزیترومایسین (یک ماکرولید) به عنوان آخرین خط دفاعی خوراکی مطرح شد. آزیترومایسین به دلیل کارایی بالا، نیاز به دوز کمتر و تحملپذیری بهتر، به سرعت به استاندارد طلایی برای درمان موارد شدید و پیچیده حصبه مقاوم تبدیل شد. با این حال، این سنگر نیز اکنون تحت محاصره قرار گرفته است.
گسترش مکانیزمهای مقاومت به آزیترومایسین
مقاومت به ماکرولیدها در باکتریها معمولاً از طریق جهش در ژنهای ریبوزومی (مانند جهش در ناحیه ۲۳S rRNA) یا از طریق مکانیسمهای پمپاژ فعال صورت میگیرد. در مورد سالمونلا تایفی XDR، اولین نشانههای مقاومت به آزیترومایسین در سال ۲۰۱۸ و ۲۰۱۹ در پاکستان مشاهده شد. این مقاومت معمولاً از طریق کسب یک پلاسمید حامل ژنهای مقاومت به ماکرولیدها (مانند mph(A)) رخ میدهد.
این جهشها یا اکتسابها، به باکتری این توانایی را میدهند که دوزهای درمانی آزیترومایسین را تحمل کند. متأسفانه، با توجه به اینکه این پلاسمیدها معمولاً چندین ژن مقاومت را به همراه دارند، اکتساب مقاومت به آزیترومایسین اغلب در همان پلاسمیدی رخ میدهد که مسئول مقاومت به سایر داروها است، و این امر مقاومت را به طور همزمان تقویت میکند.
پیامد جهانی؛ اگر این آخرین خط دفاعی از بین برود چه میشود؟
سناریویی که در آن آزیترومایسین نیز کارایی خود را از دست بدهد، یک کابوس بهداشتی را تداعی میکند. این وضعیت به معنای “حصبه کاملاً مقاوم دارویی” (TDR Typhoid) یا حداقل عدم وجود درمان خوراکی مؤثر است.
تحلیل سناریو:
اگر مقاومت کامل به آزیترومایسین فراگیر شود، درمان بیماران حصبه به شدت محدود میشود:
- بازگشت به درمانهای تزریقی: پزشکان مجبور خواهند شد به داروهایی مانند سفتریاکسون (نسل سوم سفالوسپورینها) بازگردند که اغلب باید به صورت تزریقی تجویز شوند و نگهداری آنها در محیطهای با منابع محدود دشوارتر است.
- افزایش بستری و مرگ و میر: درمانهای تزریقی پرهزینهتر بوده و نیاز به نظارت پزشکی دقیقتری دارند. در مناطقی که دسترسی به مراقبتهای بیمارستانی محدود است، این امر منجر به افزایش چشمگیر نرخ مرگ و میر (Case Fatality Rate) خواهد شد، به خصوص در کودکان و سالمندان.
- تضعیف کنترل شیوع: ناتوانی در درمان سرپایی سریع و مؤثر، باعث طولانیتر شدن دوره عفونتزایی فرد مبتلا و افزایش احتمال انتقال بیماری در جامعه میشود. در نهایت، این امر یک چرخه معیوب ایجاد میکند که در آن بیماریهای قابل پیشگیری، به دلیل ناتوانی در درمان، مجدداً به عامل اصلی مرگ و میر تبدیل میشوند.
این وضعیت، ضرورت تسریع در توسعه و توزیع واکسنهای نسل جدید را بیش از پیش نمایان میسازد.
بار جهانی بیماری: ابعاد تراژیک حصبه XDR
حصبه، حتی در اشکال حساس به دارو، یک بار جهانی قابل توجه ایجاد میکند. اما سویه XDR این بار را به مرزهای بحران میرساند.
تخمینهای قدیمیتر نشان میدادند که سالانه ۱۳ میلیون نفر در سراسر جهان به حصبه مبتلا میشوند. با ظهور XDR، نگرانی اصلی نه تنها در مورد تعداد مبتلایان، بلکه در مورد اثربخشی درمان است. در غیاب آنتیبیوتیکهای مؤثر، نرخ مرگ و میر در موارد شدید میتواند به ۲۰ تا ۳۰ درصد برسد، در حالی که با درمان مناسب با آنتیبیوتیکهای حساس، این نرخ به زیر ۱ درصد کاهش مییابد.
چرا کشورهای کمدرآمد بیشترین آسیب را میبینند؟
همبستگی بین فقر و حصبه یک واقعیت تلخ است. کشورهای کمدرآمد (Low-Income Countries – LICs) و کشورهای با درآمد متوسط رو به پایین (LMICs) در جنوب آسیا و آفریقا، قربانیان اصلی این بحران هستند. دلایل این امر چندوجهی است:
- زیرساختهای آب و فاضلاب: فقدان شبکههای آب آشامیدنی تصفیهشده و سیستمهای جمعآوری و تصفیه بهداشتی، محیط ایدهآلی برای انتقال سالمونلا تایفی فراهم میکند.
- نظارت ضعیف دارویی: در بسیاری از این مناطق، آنتیبیوتیکها بدون نسخه یا با نظارت بسیار کم توزیع میشوند، که خود عامل اصلی انتخاب سویههای مقاوم است.
- سیستمهای بهداشتی تحت فشار: سیستمهای مراقبت اولیه اغلب فاقد منابع لازم برای تشخیص سریع و آزمایش حساسیت دارویی هستند، بنابراین پزشکان اغلب مجبورند بر اساس شایعترین علت (و نه لزوماً سویه موجود) درمان را شروع کنند، که این امر به مصرف گسترده آنتیبیوتیکهای قدیمیتر منجر میشود و فشار انتخابی را افزایش میدهد.
نقش آب ناسالم و زیرساخت ضعیف
منبع اصلی انتقال حصبه، مسیر مدفوعی-دهانی است که غالباً از طریق آلودگی آب آشامیدنی یا مواد غذایی توسط فاضلاب انسانی انجام میشود. در مناطق شهری پرجمعیت پاکستان، رشد سریع شهرنشینی بدون برنامه ریزی کافی برای توسعه زیرساختهای تصفیه آب، باعث شده است که آلودگی متقاطع بین آب آشامیدنی و منابع فاضلاب به یک مشکل مزمن تبدیل شود. این محیط، یک “محفظه انکوباتور” ایدهآل برای تکامل سویههایی است که در برابر داروهای موجود مقاوم هستند، زیرا آلودگی مداوم اطمینان میدهد که همیشه میزبانهای جدیدی برای بقای باکتریها وجود دارد.
واکسنهای کنژوگه حصبه؛ مهمترین امید بشر
در مواجهه با شکاف فزاینده بین سرعت تکامل مقاومت و سرعت توسعه داروهای جدید، واکسنها به عنوان یک راهکار پیشگیریکننده و پایدار مطرح میشوند. واکسنهای قدیمیتر حصبه (پلیساکاریدی) کارایی محدودی داشتند و برای کودکان خردسال مناسب نبودند. اما ظهور واکسنهای کنژوگه حصبه (Typhoid Conjugate Vaccines – TCVs) یک نقطه عطف محسوب میشود.
معرفی واکسنهای تأییدشده WHO تا ۲۰۲۵
واکسنهای کنژوگه، انقلابی در ایمنیزایی ایجاد کردهاند. آنها با اتصال آنتیژن پلیساکاریدی کپسول باکتری به یک پروتئین حامل (Conjugation)، پاسخ ایمنی بدن را به شکل قابل توجهی تقویت میکنند. این کار باعث میشود سیستم ایمنی، به ویژه در نوزادان و کودکان خردسال (که پاسخ ایمنی ضعیفی به واکسنهای پلیساکاریدی دارند)، آنتیبادیهای قوی و طولانیمدتی تولید کند.
تا سال ۲۰۲۵، چندین واکسن کنژوگه مورد تأیید سازمان بهداشت جهانی (WHO) قرار گرفتهاند، از جمله Vi-CPS و TCV. این واکسنها کارایی بالایی (بین ۷۰ تا ۹۰ درصد) در پیشگیری از بیماری حصبه در جمعیتهای هدف نشان دادهاند و مهمتر از همه، برای اولین بار، امکان واکسیناسیون روتین در برنامه ملی ایمنسازی کودکان را فراهم کردهاند.
تجربه موفق واکسیناسیون روتین در پاکستان
پاکستان، که خود کانون شیوع XDR است، یک آزمایشگاه واقعی برای اثربخشی واکسنهای کنژوگه شد. در پاسخ به موج XDR، مقامات بهداشتی پاکستان در سال ۲۰۲۱ یک برنامه واکسیناسیون روتین برای کودکان در استانهای سند و پنجاب آغاز کردند. این اقدام، بر اساس توصیههای WHO مبنی بر استفاده از TCV در مناطق با شیوع بالا صورت گرفت.
دادههای اولیه از این برنامه، اثربخشی سریع این واکسنها در کاهش میزان موارد حصبه را تأیید کردند. استفاده از TCV به عنوان بخشی از یک استراتژی چندوجهی (شامل بهداشت و درمان)، نشان داد که میتوان شیوع یک سویه سرکش را در یک محیط پرخطر کنترل کرد. این موفقیت یک الگوی جهانی برای سایر مناطق اندمیک است.
موانع دسترسی جهانی به واکسنها
با وجود اثربخشی اثباتشده، بزرگترین چالش در حال حاضر، دسترسی عادلانه به این واکسنها است.
- هزینه: اگرچه قیمت TCVها با تولید بیشتر کاهش یافته است، اما هنوز برای بسیاری از کشورهای کمدرآمد، گنجاندن آنها در بودجه ملی ایمنسازی چالشبرانگیز است. نیاز به حمایت مالی از سوی سازمانهایی مانند Gavi (ائتلاف جهانی واکسن) برای اطمینان از توزیع برابر ضروری است.
- ظرفیت تولید: تقاضای جهانی برای این واکسنها بالاست، و تأمین سریع و کافی برای پوشش جمعیتهای هدف در دهها کشور درگیر، نیازمند افزایش چشمگیر ظرفیت تولید جهانی است.
- زیرساختهای توزیع: در مناطقی که سیستمهای زنجیره سرد ضعیفی دارند، رساندن واکسن به دورافتادهترین روستاها یک مانع لجستیکی بزرگ است.
آینده درمان؛ آیا آنتیبیوتیکهای جدید کافی خواهند بود؟
در حالی که پیشگیری از طریق واکسنها حیاتی است، درمان موارد موجود و همچنین مقابله با موجهای آتی مقاوم، نیازمند ورود داروهای جدید به عرصه رقابت است. متأسفانه، چشمانداز توسعه آنتیبیوتیکهای جدید بسیار تاریک است.
چرا توسعه آنتیبیوتیک جدید اینقدر دشوار است؟
توسعه آنتیبیوتیکهای جدید برای بازار جهانی به شدت با موانع اقتصادی و علمی روبروست:
- بازده اقتصادی پایین: شرکتهای دارویی به دنبال داروهایی هستند که بتوانند برای سالها مصرف شوند و سودآوری بالایی داشته باشند (مانند داروهای مزمن). آنتیبیوتیکها، که باید به صورت کوتاهمدت و تنها در صورت لزوم استفاده شوند تا مقاومت ایجاد نشود، بازده سرمایهگذاری بسیار پایینی دارند.
- طولانی بودن فرآیند تحقیق و توسعه (R&D): کشف یک مولکول جدید، عبور از مراحل بالینی فشرده و تأیید نظارتی، اغلب بیش از یک دهه طول میکشد.
- سرعت مقاومت: میکروبها اغلب بسیار سریعتر از دانشمندان راهی برای دور زدن یک داروی جدید پیدا میکنند.
نقش سازمانها و دولتها در سرمایهگذاری
برای غلبه بر این موانع، مدلهای تأمین مالی عمومی و خصوصی (Public-Private Partnerships – PPPs) ضروری شدهاند. سازمانهایی مانند CARB-X و پروژههایی تحت حمایت دولتها در اروپا و آمریکا، با هدف کاهش ریسک مالی برای شرکتهای دارویی، بر توسعه داروهای جدید متمرکز شدهاند. برای سالمونلا تایفی، تمرکز بر روی کلاسهای دارویی جدید مانند سایدروفورها (Siderophores) یا ترکیبات جدیدی که قادر به دور زدن پمپهای خروجی هستند، در جریان است. با این حال، زمان مورد نیاز برای ورود این داروها به بازار، فاصله قابل توجهی با نیاز فوری برای درمان سویههای XDR دارد.
پیامدهای اجتماعی–اقتصادی شیوع یک ابرمیکروب جهانی
شیوع XDR حصبه تنها یک بحران سلامت عمومی نیست؛ بلکه یک شوک اقتصادی و اجتماعی است که میتواند ثبات جوامع آسیبپذیر را تهدید کند.
بار سیستمهای بهداشتی و زیان اقتصادی
هنگامی که خطوط اول درمان شکست میخورند، بیماران برای مدت طولانیتری بیمار میمانند، نیاز به بستری در بیمارستان دارند و هزینههای مراقبت به شدت افزایش مییابد. این امر سیستمهای بهداشتی که از قبل ضعیف هستند را تحت فشار غیرقابل تحملی قرار میدهد.
از منظر اقتصادی، حصبه XDR منجر به از دست رفتن سالهای تولیدی نیروی کار میشود. در مناطقی که بیماری از طریق آب آلوده شیوع مییابد، اعتماد عمومی به منابع عمومی تضعیف شده و حتی بخش گردشگری محلی متضرر میشود. برآوردها نشان میدهند که هزینههای مستقیم درمانی و غیرمستقیم ناشی از این بیماری، میتواند درصد قابل توجهی از تولید ناخالص داخلی (GDP) کشورهای اندمیک را مصرف کند.
آسیبپذیری کودکان و سالمندان
کودکان زیر پنج سال به طور طبیعی در برابر حصبه آسیبپذیرترند، زیرا سیستم ایمنی آنها هنوز به طور کامل توسعه نیافته است. در صورت ابتلا به XDR، میزان مرگ و میر در این گروه سنی به دلیل ناتوانی در جذب مواد مغذی و کم آبی شدید، به طور فزایندهای بالا میرود. سالمندان نیز به دلیل ضعف سیستم ایمنی و وجود بیماریهای زمینهای، در معرض خطر بالای نتایج نامطلوب هستند.
خطر بحران در مناطق پرجمعیت
مناطقی مانند اردوگاههای آوارگان، زاغهنشینهای شهری، و مناطق با ازدحام بالا (مانند مراکز زیارتی یا مهاجرتی) به دلیل تراکم افراد و اغلب ضعف شدید در کنترل بهداشت محیط، به کانونهای بالقوه برای انفجار شیوع XDR تبدیل میشوند. در این مناطق، یک مورد وارداتی میتواند به سرعت به یک اپیدمی کنترلناپذیر تبدیل شود، زیرا منابع برای ایزولهسازی و درمان کافی نیستند.
چه باید کرد؟ راهکارهای فوری و بلندمدت
مقابله با تهدید چندوجهی حصبه XDR نیازمند یک استراتژی جامع است که نه تنها به درمان، بلکه به پیشگیری، نظارت، و بهبود زیرساختها میپردازد.
گسترش واکسیناسیون؛ حرکت سریع به سمت پوشش همگانی
گسترش فوری واکسیناسیون کنژوگه حصبه (TCV) در تمام مناطق اندمیک، از جمله مناطقی که شیوع بالایی ندارند اما خطر انتقال از مناطق همسایه وجود دارد، باید در اولویت قرار گیرد.
- واکسیناسیون هدفمند (Catch-up): اجرای کمپینهای واکسیناسیون در میان گروههای پرخطر، به ویژه کودکان در مناطق شهری متراکم پاکستان و کشورهای جنوب آسیا.
- تضمین عرضه پایدار: دولتها و سازمانهای بینالمللی باید با تولیدکنندگان برای اطمینان از قیمتگذاری مناسب و تأمین دوزهای کافی در سالهای آینده همکاری کنند.
تقویت سیستمهای پایش و تشخیص (Genomic Surveillance)
فقط با دانستن اینکه میکروب دقیقاً کجاست و چه مقاومتی دارد، میتوان به طور مؤثر واکنش نشان داد.
- نظارت ژنومی سراسری: توسعه آزمایشگاههای مجهز در مناطق درگیر برای توالییابی منظم ایزولههای بالینی. این امر به شناسایی سریع ظهور سویههای جدید (مانند مقاومت به آزیترومایسین) پیش از تبدیل شدن آنها به یک اپیدمی کمک میکند.
- آزمایش حساسیت آنتیبیوتیکی سریع: تجهیز کلینیکها به کیتهایی که بتوانند به سرعت حساسیت باکتریهای جدا شده را مشخص کنند تا از درمانهای ناکارآمد جلوگیری شود.
آموزش عمومی و بهداشت آب و فاضلاب
کنترل XDR در نهایت به شکستن زنجیره انتقال مدفوعی-دهانی وابسته است.
- سرمایهگذاری در زیرساختها: سرمایهگذاری بلندمدت و قابل توجه در تصفیه آب و سیستمهای فاضلاب در مناطق اندمیک، به ویژه در پاکستان و کشورهای جنوب آسیا، حیاتی است. این سرمایهگذاریها باید بخشی از برنامههای توسعه پایدار ملی باشند.
- بهداشت دست و غذای ایمن: کمپینهای آموزشی متمرکز بر شستشوی دستها با صابون، ایمنی مواد غذایی (به ویژه مواد غذایی فروخته شده در خیابانها) و استفاده از آب جوشیده یا تصفیهشده.
اقدام فوری برای مقابله با مقاومت آنتیبیوتیکی
مدیریت دقیق مصرف آنتیبیوتیکها در همه بخشها (انسانی، دامپزشکی، و کشاورزی) باید تقویت شود.
- محدودیت در استفاده از داروهای حیاتی: آنتیبیوتیکهایی که هنوز در برابر XDR مؤثر هستند (مانند سفتریاکسون) باید تنها تحت نظارت دقیق و تنها برای موارد تأیید شده حصبه به کار روند تا زمان ظهور درمانهای جدید، عمر مفید آنها حفظ شود.
- حذف تجویز خودسرانه: اجرای قوانین سختگیرانهتر برای فروش آنتیبیوتیکها بدون نسخه پزشک.
جمعبندی طلایی
شیوع سویه فوقخطرناک حصبه، زنگ خطری است که نشان میدهد مبارزه با بیماریهای عفونی قدیمی هنوز به پایان نرسیده است. این سویه، نه یک شکست پزشکی، بلکه نمادی از پیامدهای جهانی استفاده نامناسب از منابع محدود ماست. حصبه XDR به ما یادآوری میکند که میکروبها در یک محیط رقابتی جهانی عمل میکنند و ضعفهای زیرساختی در یک کشور، میتواند مستقیماً سلامت میلیونها نفر در سراسر جهان را تهدید کند.
راه برونرفت از این بحران، ترکیبی از استراتژیهای نوآورانه و مداخلات بهداشت عمومی سنتی است. واکسیناسیون کنژوگه، به عنوان سپری حیاتی در برابر این تهدید، باید با حداکثر سرعت ممکن به دست آسیبپذیرترین کودکان برسد. همزمان، نظارت ژنومی باید به ابزاری روزمره در تشخیص زودهنگام تهدیدات تبدیل شود، و سرمایهگذاری در زیرساختهای آب و فاضلاب، ریشههای اپیدمیولوژیک را بخشکاند. اگر جامعه جهانی نتواند هماهنگی لازم برای مقابله با این تهدید تکاملی را به نمایش بگذارد، ممکن است شاهد بازگشت گسترده حصبه به عنوان یک قاتل اصلی در قرن بیست و یکم باشیم؛ سناریویی که به هیچ وجه در شأن یک عصر پیشرفته علمی نیست.
سوالات متداول درباره حصبه و سویه XDR (FAQ)
۱. حصبه چیست و چگونه منتقل میشود؟
حصبه یک عفونت رودهای شدید است که توسط باکتری سالمونلا تایفی ایجاد میشود. این بیماری عمدتاً از طریق مصرف آب یا غذایی که با مدفوع افراد آلوده آلوده شده باشد، منتقل میشود. این بیماری به دلیل علائمی مانند تب شدید طولانیمدت، ضعف مفرط و درگیری سیستمیک شناخته میشود.
۲. تفاوت بین حصبه معمولی و سویه XDR حصبه چیست؟
سویه XDR (Extensively Drug-Resistant) حصبه، سویهای است که نسبت به آنتیبیوتیکهای نسل اول (مانند کلرامفنیکل و آمپیسیلین) و همچنین فلوروکینولونها (مانند سیپروفلوکساسین) مقاوم شده است. به عبارت دیگر، درمان آن با اکثر داروهای خوراکی استاندارد شکست میخورد و گزینههای درمانی را به شدت محدود میکند.
۳. پاکستان دقیقاً چه نقشی در این بحران داشته است؟
پاکستان، به ویژه منطقه سند، به عنوان کانون اصلی تکامل سویه XDR شناخته میشود. ترکیبی از تراکم بالای جمعیت، چالشهای زیرساختی در زمینه آب و فاضلاب، و استفاده گسترده از آنتیبیوتیکها، محیطی ایدهآل برای انباشت جهشهای مقاومت دارویی در سویه سالمونلا تایفی فراهم کرد.
۴. چرا سویههای مقاوم دارویی به سرعت در حال جایگزینی سویههای حساس هستند؟
این پدیده ناشی از فشار انتخابی (Selection Pressure) است. در محیطهایی که آنتیبیوتیکها به طور مکرر و گاهی نامناسب استفاده میشوند، باکتریهای مقاوم زنده میمانند و تکثیر میشوند، در حالی که باکتریهای حساس از بین میروند. این امر منجر به تسلط سویههای مقاوم در جمعیت باکتریایی میشود.
۵. آزیترومایسین در حال حاضر چه جایگاهی در درمان XDR دارد؟
آزیترومایسین در حال حاضر یکی از آخرین خطوط دفاعی خوراکی مؤثر در برابر سویههای XDR محسوب میشود، به خصوص زمانی که مقاومت به فلوروکینولونها وجود داشته باشد. با این حال، نگرانیهای فزایندهای در مورد ظهور مقاومت نسبت به آزیترومایسین (و تبدیل شدن به سویه TDR یا کاملاً مقاوم) در حال افزایش است.
۶. واکسنهای کنژوگه حصبه (TCV) چگونه کار میکنند و چرا مهم هستند؟
TCVها نسل جدیدی از واکسنها هستند که پلیساکاریدهای سطحی باکتری را به یک پروتئین حامل متصل میکنند. این کار باعث میشود که سیستم ایمنی بدن، به ویژه در نوزادان و کودکان خردسال، پاسخ ایمنی قوی و طولانیمدتتری نسبت به نسلهای قبلی واکسنها ایجاد کند و اثربخشی بالاتری در پیشگیری از بیماری، حتی در مناطق با شیوع بالا، ارائه دهد.
۷. آیا واکسیناسیون میتواند به تنهایی مشکل XDR را حل کند؟
خیر. واکسنها ابزاری قدرتمند برای پیشگیری هستند، اما تنها بخشی از راهکار هستند. برای کنترل پایدار حصبه، باید همزمان با واکسیناسیون، بر بهبود زیرساختهای بهداشت عمومی (آب و فاضلاب) و مدیریت مصرف آنتیبیوتیکها تمرکز شود.
۸. اگر کسی به XDR حصبه مبتلا شود و درمان خوراکی مؤثر نباشد، چه اتفاقی میافتد؟
در صورت شکست درمان خوراکی (مانند آزیترومایسین)، پزشکان باید به آنتیبیوتیکهای تزریقی مانند سفتریاکسون روی بیاورند. این امر نیاز به بستری شدن در بیمارستان دارد و هزینههای درمانی و خطر مرگ و میر را به شدت افزایش میدهد، به خصوص در مناطقی که دسترسی به مراقبتهای بیمارستانی پیشرفته محدود است.
۹. آیا سفرهای بینالمللی نقشی در گسترش XDR حصبه دارند؟
بله. مسافران و زائرانی که در مناطق آلوده (مانند پاکستان) عفونت کسب میکنند و بدون علامت یا با علائم خفیف به کشورهای دیگر سفر میکنند، میتوانند این سویه مقاوم را به مناطق جدیدی منتقل کنند. نظارت بر مسافران بازگشتی از مناطق پرخطر برای جلوگیری از استقرار داخلی این سویه ضروری است.
۱۰. چه اقداماتی برای مقابله با مقاومت آنتیبیوتیکی به طور کلی ضروری است؟
اقدامات ضروری شامل: ۱) اجرای سختگیرانه قوانین فروش بدون نسخه آنتیبیوتیک، ۲) سرمایهگذاری در تحقیق و توسعه داروهای جدید، ۳) نظارت جهانی بر الگوهای مقاومت دارویی (نظارت ژنومی)، و ۴) آموزش عمومی در مورد پایان دادن به دورههای مصرف آنتیبیوتیکها به محض احساس بهبودی.
۱۱. چه زمانی انتظار میرود داروهای جدیدی برای درمان XDR حصبه در دسترس قرار گیرند؟
توسعه آنتیبیوتیکهای جدید فرآیندی طولانی و پرهزینه است. اگرچه تحقیقاتی در جریان است، اما ورود درمانهای جدید به بازار اغلب چندین سال زمان میبرد. به همین دلیل، حفظ اثربخشی داروهای موجود و افزایش پوشش واکسیناسیون اهمیت حیاتی دارد.
۱۲. آیا حصبه XDR میتواند مانند کووید-۱۹ به یک پاندمی گسترده تبدیل شود؟
اگرچه شیوع XDR حصبه پتانسیل یک بیماری همهگیر را دارد، اما مسیر انتقال آن (از طریق آب و غذا) کنترلپذیرتر از یک بیماری تنفسی مانند کووید-۱۹ است. با این حال، عدم وجود درمان مؤثر میتواند در مناطق پرجمعیت و با زیرساخت ضعیف، منجر به افزایش شدید موارد و مرگ و میر شود و یک بحران جهانی را رقم بزند.
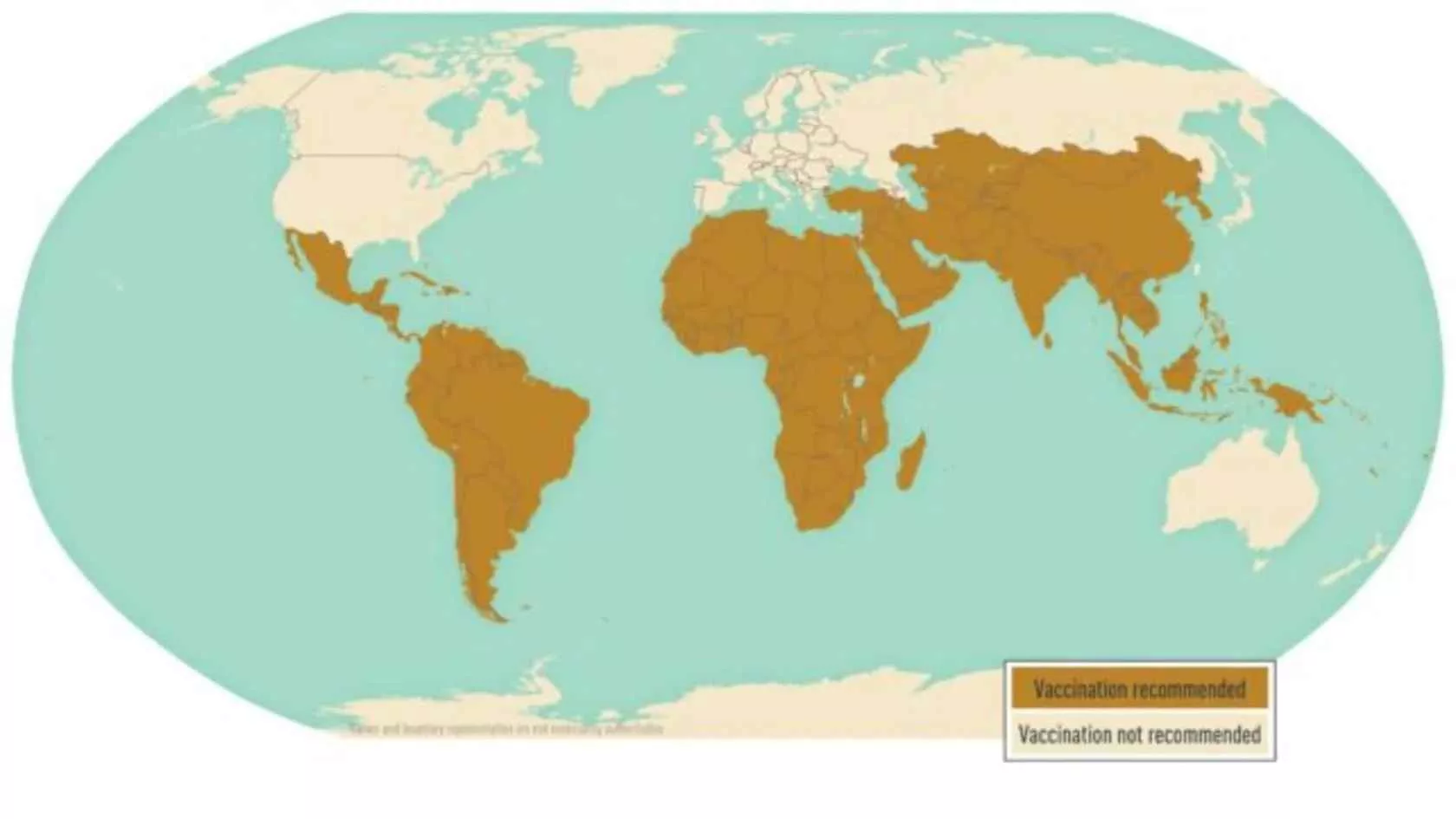
۱۳. آیا واکسیناسیون برای افرادی که به پاکستان یا کشورهای همسایه سفر میکنند توصیه میشود؟
بله، با توجه به شیوع بالا و مقاومت دارویی شدید، سازمانهای بهداشت جهانی قویاً توصیه میکنند که تمام مسافران، به ویژه آنهایی که قصد اقامت طولانی یا سفر به مناطق روستایی را دارند، پیش از سفر واکسن کنژوگه حصبه را دریافت کنند.
۱۴. عوامل اصلی گسترش حصبه در مناطق شهری پرجمعیت چیست؟
عوامل اصلی شامل تراکم بالای جمعیت، دسترسی ناکافی و غیرایمن به آب آشامیدنی تصفیهشده، ضعف یا عدم وجود سیستمهای دفع فاضلاب مناسب، و بهداشت فردی ضعیف است که همگی زنجیره انتقال مدفوعی-دهانی را تقویت میکنند.
۱۵. آیا واکسیناسیون روتین در پاکستان تاکنون موفقیتآمیز بوده است؟
بله، دادههای اولیه از برنامه واکسیناسیون روتین در استانهای پاکستان نشان داده است که TCVها در کاهش سریع نرخ بروز بیماری در جمعیت هدف، بسیار مؤثر بودهاند و این موفقیت یک الگوی مهم برای سایر کشورهای با شیوع بالا فراهم کرده است.