کشفی شگفتانگیز در مغز؛ سلولهای ایمنی ناشناختهای که اضطراب را تنظیم میکنند
فراتر از نورونها؛ نقش سلولهای ایمنی مغز در کنترل اضطراب
انقلاب در علوم اعصاب؛ نگاهی به نیروهای خاموش مغز
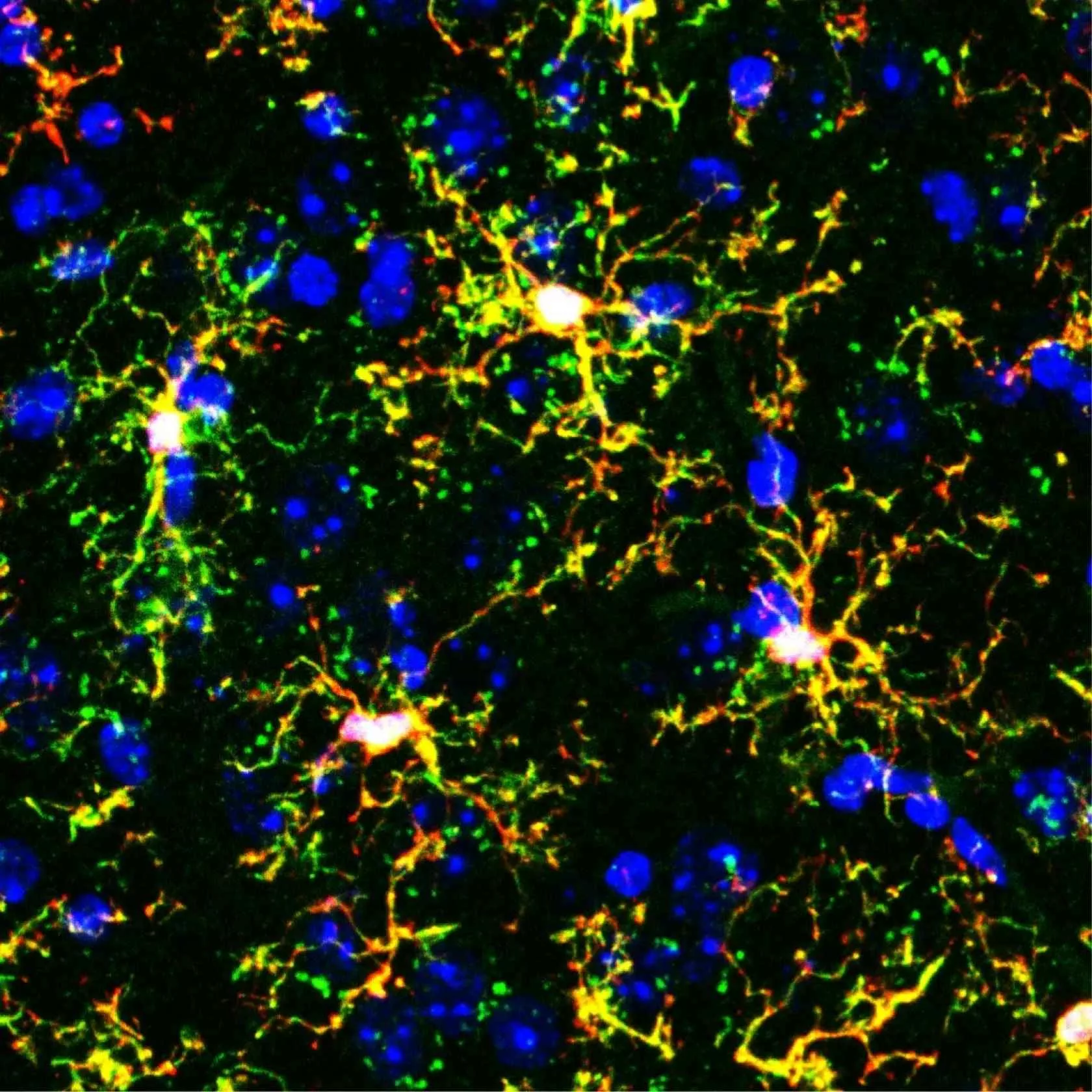
اضطراب، یکی از شایعترین اختلالات روانپزشکی در جهان، سالهاست که محور اصلی تحقیقات علوم اعصاب بوده است. تمرکز سنتی بر برهمکنشهای نورونی، سیناپسها و انتقالدهندههای عصبی مانند سروتونین و گابا، اگرچه پیشرفتهای مهمی به همراه داشته، اما نتوانسته است تصویری کامل از مکانیسمهای پیچیده تنظیم خلقوخو ارائه دهد. در سالهای اخیر، کانون توجه به سرعت در حال تغییر به سمت ارتش خاموش مغز، یعنی سلولهای ایمنی مغز یا میکروگلیا (Microglia)، معطوف شده است.
میکروگلیا، نگهبانان اولیه سیستم عصبی مرکزی (CNS)، دیگر صرفاً به عنوان جاروگرهای زباله یا دفاعکنندگان در برابر پاتوژنها در نظر گرفته نمیشوند. پژوهشهای پیشگامانه نشان میدهند که این سلولهای ساکن مغز، نقشهای فعالی در شکلدهی مدارهای عصبی، تنظیم سیناپسها و بهویژه، تعدیل پاسخهای رفتاری ما به استرس و تهدید دارند. درک این نقش محوری، کلید گشودن قفل درمانهای جدید برای اختلالات اضطرابی است.
این مقاله تحلیلی، به بررسی یافتههای انقلابی اخیر درباره چگونگی تأثیر زیرگروههای خاصی از میکروگلیا بر معماری اضطراب میپردازد. ما نه تنها بر اهمیت وجود میکروگلیا تأکید میکنیم، بلکه با تشریح کشف دو جمعیت متضاد از این سلولها – آنهایی که بیان ژن Hoxb8 را نشان میدهند و آنهایی که فاقد این نشانگر هستند – سعی میکنیم پرده از مکانیزمهای مولکولی دقیقی برداریم که اضطراب را در مغز ما هدایت یا مهار میکنند. این کشف، اساساً تعاریف ما از سلامت روان را بازنویسی میکند و پنجرهای جدید به سوی هدفگیری دقیقتر دارویی میگشاید.
این مقاله در مجله علمی پژوهشی معتبر Molecular Psychiatry انتشار یافته است.
بدنه تحلیلی: میکروگلیا؛ از دفاع تا تنظیم رفتار
میکروگلیاها، که تنها حدود ۵ تا ۱۵ درصد از کل سلولهای مغز را تشکیل میدهند، به دلیل توانایی فوقالعادهشان در تغییر وضعیت و شکل ظاهریشان، از اهمیت ویژهای برخوردارند. در حالت طبیعی و آرام (Resting State)، این سلولها دارای شاخههای ظریف و متحرکی هستند که به طور مداوم محیط اطراف خود را اسکن میکنند. اما در مواجهه با آسیب، التهاب یا تغییرات شیمیایی، به سرعت فعال شده و ریختشناسی (مورفولوژی) خود را تغییر میدهند تا به مکانیسمهای ترمیم و پاسخ ایمنی بپردازند.
تأثیرات میکروگلیا بر سلامت روان: فراتر از التهاب
در گذشته، ارتباط بین سیستم ایمنی و اختلالات روانی، عمدتاً از طریق لنز التهاب مزمن مورد بررسی قرار میگرفت. افزایش سیتوکینهای التهابی در بیمارانی که از افسردگی یا اضطراب رنج میبرند، مشاهده شده بود. با این حال، نقش میکروگلیا در تنظیم رفتار در غیاب یک عامل آسیبزای آشکار، به تازگی مورد توجه قرار گرفته است.
میکروگلیا در توسعه مغز، نقش حیاتی در «هرس سیناپسی» (Synaptic Pruning) ایفا میکنند. آنها مانند باغبانی دقیق، اتصالات عصبی ضعیف یا غیرضروری را شناسایی کرده و آنها را از بین میبرند تا مدارهای عصبی بهینه شوند. این فرآیند برای یادگیری و انعطافپذیری عصبی (Neuroplasticity) ضروری است. اگر این هرس سیناپسی در مراحل حساس رشد یا در نواحی کلیدی مغز مانند آمیگدال (مرکز پردازش ترس) و هیپوکامپ (مرکز حافظه و کنترل استرس) مختل شود، احتمال بروز اختلالات خلقی و اضطرابی افزایش مییابد.
کشف دو جناح متضاد: Hoxb8 به مثابه یک نقطه عطف
جدیدترین یافتهها در حوزه علوم اعصاب مولکولی نشان میدهند که میکروگلیاها یک گروه همگن نیستند، بلکه دارای زیرجمعیتهایی با عملکردهای تخصصی و حتی متضاد هستند. تمایز کلیدی که اخیراً کشف شده، بر اساس بیان یک ژن خاص به نام Hoxb8 است.
Hoxb8 یک عامل رونویسی (Transcription Factor) است که در مراحل اولیه تکوین عصبی نقش دارد و در جمعیتهای خاصی از سلولهای ایمنی مغز، بقای خود را حفظ کرده و فعال باقی میماند. پژوهشگران دریافتند که تقسیمبندی میکروگلیا به دو گروه زیر صورت میگیرد:
- میکروگلیاهای Hoxb8 مثبت ($\text{MG}_{\text{Hoxb8+}}$): این جمعیت، ظاهراً مسئول تعدیل و مهار پاسخهای بیش از حد اضطرابی هستند. آنها در حالت پایه فعال بوده و به نظر میرسد مانند “ترمز اضطراب” عمل میکنند.
- میکروگلیاهای Hoxb8 منفی ($\text{MG}_{\text{Hoxb8-}}$): این گروه، که بیانگر ویژگیهای ایمنی کلاسیکتر هستند، در شرایط استرس مزمن یا التهاب، فعال شده و میتوانند به طور مستقیم یا غیرمستقیم باعث افزایش حساسیت مدارهای عصبی به ترس و اضطراب شوند. اینها نقش “پدال گاز اضطراب” را ایفا میکنند.
این تمایز، اولین بار به صورت ساختاریافتهای در بافتهای مغزی مورد مطالعه قرار گرفت و نشان داد که تنظیم ژنتیکی در خود سلولهای ایمنی، تعیینکننده نحوه تجربه ما از استرس است.
نقش متضاد Hoxb8+ و Hoxb8- در تنظیم اضطراب: پویاییهای مولکولی
برای درک عمق این کشف، باید به مکانیسمهایی بپردازیم که این دو زیرگروه را متمایز و عملکردشان را تعیین میکند. این بحث، مستلزم ورود به لایههای عمیقتر زیستشناسی سلولی و مولکولی است.
عملکرد $\text{MG}_{\text{Hoxb8+}}$: ترمزگیرهای اضطراب
جمعیت $\text{MG}_{\text{Hoxb8+}}$، که به طور مداوم Hoxb8 را بیان میکنند، به نظر میرسد که حالت هموستاتیک (تعادل) مغز را حفظ میکنند. تحقیقات نشان دادهاند که این سلولها مسئول نگهداری از سطح مناسبی از سیناپسها در نواحی حیاتی مانند قشر پیشپیشانی (Prefrontal Cortex – PFC) هستند که مسئول تنظیم هیجانات است.
مکانیسم پیشنهادی:
در حالت عادی، $\text{MG}_{\text{Hoxb8+}}$ ممکن است از طریق ترشح فاکتورهای نوروتروفیک خاص (مانند BDNF در سطوح پایین و پایدار) یا از طریق تعامل مستقیم با گیرندههای خاصی روی نورونها، سیناپسها را در حالت “بهینه تحریکپذیری” نگه دارند. فقدان این سلولها یا کاهش فعالیت آنها، باعث میشود که نورونها بیش از حد هیجانپذیر شده و به محرکهای خفیف با پاسخی اغراقآمیز (اضطراب) واکنش نشان دهند.
تشبیه عملی: تصور کنید شبکه عصبی شما یک ماشین است. $\text{MG}_{\text{Hoxb8+}}$ مانند سیستم کنترل پایداری خودرو عمل میکند که در سرعتهای بالا ترمزگیریهای کوچک و دقیق انجام میدهد تا از لغزش جلوگیری کند. آنها حضور دارند تا ماشین از مسیر خارج نشود.
عملکرد $\text{MG}_{\text{Hoxb8-}}$: پدال گاز فعالکننده ترس
در مقابل، جمعیت $\text{MG}_{\text{Hoxb8-}}$ بیشتر شبیه به سلولهای ایمنی سنتی عمل میکنند که در پاسخ به سیگنالهای خطر (مانند استرس مزمن، کمخوابی یا آسیب محیطی) فعال میشوند. وقتی استرس مزمن میشود، این سلولها وضعیت خود را از حالت استراحت به وضعیت فعال (Activated State) تغییر میدهند.
فعالیت بیش از حد $\text{MG}_{\text{Hoxb8-}}$ میتواند به دو شیوه منجر به اضطراب شود:
- التهاب موضعی: آزادسازی سیتوکینهای پیشالتهابی (مانند IL-1$\beta$ و TNF-$\alpha$) که حساسیت آمیگدال به سیگنالهای ترس را افزایش میدهد. این حالت، مغز را در وضعیت “آمادهباش جنگ یا گریز” دائمی نگه میدارد.
- افزایش هرس سیناپسی غیرطبیعی: در شرایط استرس مزمن، $\text{MG}_{\text{Hoxb8-}}$ ممکن است شروع به پاکسازی سیناپسهایی کنند که برای تنظیم ترس ضروری هستند، بهویژه در مسیرهایی که اطلاعات از آمیگدال به PFC منتقل میشود. این پاکسازی نامتعادل باعث میشود مدارهای ترس قویتر و مدارهای کنترل، ضعیفتر شوند.
تشبیه عملی: اگر $\text{MG}{\text{Hoxb8+}}$ ترمز باشد، $\text{MG}{\text{Hoxb8-}}$ در حالت بیشفعالی، پا را روی پدال گاز میگذارد و همزمان، ترمزها را دستکاری میکند تا ماشین با سرعت زیاد وارد پیچ شود.
تنظیمپذیری و تغییر وضعیت (Plasticity)
نکته مهمی که این مدل را قدرتمند میسازد، انعطافپذیری بین این دو زیرگروه است. پژوهشها نشان میدهند که در شرایط خاص، یک زیرگروه میتواند به زیرگروه دیگر تبدیل شود. به عنوان مثال، یک محرک استرس شدید میتواند باعث شود که برخی از میکروگلیاها که قبلاً Hoxb8 بیان میکردند، این ژن را خاموش کرده و به وضعیت $\text{MG}_{\text{Hoxb8-}}$ تغییر یابند.
نتیجهگیری تحلیلی: اضطراب، صرفاً یک عدم تعادل شیمیایی در نورونها نیست؛ بلکه نتیجه یک ناهماهنگی مدیریتی در جمعیتهای میکروگلیایی است که مسئول حفظ تعادل بین تحریکپذیری عصبی و آرامش هستند. کنترل موفقیتآمیز اضطراب، نیازمند بازیابی تعادل بین فعالیت $\text{MG}{\text{Hoxb8+}}$ و $\text{MG}{\text{Hoxb8-}}$ است.
توضیح روش پژوهش: رمزگشایی از زبان ژنتیکی میکروگلیا
کشف و تفکیک این دو جمعیت، نیازمند بهکارگیری تکنیکهای پیشرفته در حوزه زیستشناسی سلولی و ژنتیک محاسباتی بود. به طور سنتی، مطالعه میکروگلیاها به دلیل شباهت ظاهریشان دشوار بود؛ اما ظهور تکنیکهای تکسلولی، این موانع را از میان برداشت.
۱. توالییابی RNA تکسلولی (scRNA-seq)
قلب این پژوهش، استفاده از تکنیک توالییابی RNA در سطح تکسلول (Single-Cell RNA Sequencing) بود. این روش به محققان اجازه داد که هزاران سلول منفرد را از بافت مغز استخراج کرده و پروفایل رونویسی (Transcriptional Profile) هر سلول را به طور جداگانه ترسیم کنند.
روند کار:
دانشمندان نمونههایی از ناحیه آمیگدال و هیپوکامپ موشهای آزمایشگاهی را که در معرض مدلهای مختلف استرس قرار گرفته بودند، جمعآوری کردند. سپس، با استفاده از ریزسیالیت (Microfluidics)، هر سلول به یک قطره حاوی واکنشدهنده تبدیل شد و محتوای RNA آن توالییابی گردید.
تحلیل دادهها:
پس از جمعآوری دادهها، الگوریتمهای یادگیری ماشین (Machine Learning) برای خوشهبندی سلولها بر اساس الگوهای بیان ژنی استفاده شد. در این خوشهبندی، جمعیتهایی با بیان بالا برای ژنهای مرتبط با عملکردهای ایمنی، و جمعیتی مجزا که بیان خاصی از مجموعه ژنهای Hox (بهویژه Hoxb8) را نشان میدادند، شناسایی شدند. این شناسایی به وضوح نشان داد که میکروگلیاها دو یا چند زیرجمعیت متمایز را تشکیل میدهند که از نظر بیانی، کاملاً متفاوت عمل میکنند.
۲. نقشهبرداری مکانی (Spatial Transcriptomics)
صرف دانستن اینکه یک سلول چه ژنی را بیان میکند کافی نیست؛ باید بدانیم آن سلول دقیقاً در کجای مغز قرار دارد. تکنیکهای نقشهبرداری رونویسی فضایی (Spatial Transcriptomics) به محققان اجازه دادند تا پروفایلهای ژنی را روی برشهای بافتی نگاشت کنند.
این امر تأیید کرد که توزیع $\text{MG}{\text{Hoxb8+}}$ و $\text{MG}{\text{Hoxb8-}}$ در نواحی مختلف مغز متفاوت است. به طور مثال، $\text{MG}{\text{Hoxb8+}}$ غلظت بیشتری در ساختارهای مرتبط با تنظیم هیجانی داشتند، در حالی که $\text{MG}{\text{Hoxb8-}}$ در زمان استرس، به نواحی آسیبپذیرتر مغز مهاجرت میکردند.
۳. مدلسازی عملکردی و دستکاری ژنتیکی
برای اثبات نقش علی (Causal Role) این جمعیتها در اضطراب، از دستکاریهای مولکولی استفاده شد:
- حذف انتخابی: با استفاده از ویرایش ژنی (مانند CRISPR) به شیوهای که تنها بیان Hoxb8 در میکروگلیاها تحت تأثیر قرار گیرد، محققان توانستند به صورت مصنوعی جمعیت $\text{MG}_{\text{Hoxb8+}}$ را حذف کنند. نتایج به طرز چشمگیری نشان داد که حذف این “ترمزها”، به طور قابل توجهی رفتار اضطرابی را در مدلهای حیوانی افزایش داد، حتی در شرایطی که سایر فاکتورهای استرس وجود نداشتند.
- فعالسازی بیش از حد: برعکس، روشهایی برای تقویت بیان Hoxb8 در میکروگلیاها به کار گرفته شد که نتایج آن کاهش محسوس در رفتارهای اضطرابی و افزایش مقاومت به استرس بود.
این روشهای ترکیبی (توصیفی، مکانی و مداخلهای) شواهد محکمی ارائه دادند که ارتباط بین Hoxb8 و تنظیم اضطراب، صرفاً یک همبستگی نیست، بلکه یک رابطه علی و معلولی مستقیم در سطح سلولهای ایمنی مغز است.
پیامدهای بالینی: تغییر پارادایم در تشخیص و درمان اضطراب
کشف نقش تفکیکشده میکروگلیاها، یک زلزله علمی در حوزه روانپزشکی محسوب میشود. اگر اضطراب یک اختلال صرفاً نورونی بود، درمانها بر نورونها متمرکز میشدند؛ اما اکنون، ما باید نقش گلیایی (Glial Role) را نیز در نظر بگیریم. این تغییر پارادایم پیامدهای عمیقی برای رویکردهای درمان اضطراب دارد.
اضطراب به مثابه یک بیماری ایمنی-عصبی (Neuro-Immune Disorder)
این یافتهها بر این ایده تأکید میکنند که بسیاری از اختلالات اضطرابی مزمن، ریشه در التهاب عصبی پنهان یا ناهنجاری در مراقبتهای میکروگلیایی دارند.
مثال بالینی:
بسیاری از بیماران مبتلا به اختلال اضطراب فراگیر (GAD) یا اختلال استرس پس از سانحه (PTSD)، سطوح بالاتری از نشانگرهای التهابی را در مایع مغزی-نخاعی (CSF) نشان میدهند. تا پیش از این، این التهاب به عنوان یک پیامد ناشی از استرس مزمن در نظر گرفته میشد. اکنون میتوان فرضیه گرفت که فعالیت غیرطبیعی $\text{MG}_{\text{Hoxb8-}}$ در واقع عامل اصلی تقویت و مزمنسازی این وضعیت اضطرابی است.
شناسایی نشانگرهای زیستی جدید (Biomarkers)
اگر بتوانیم سطوح بیان Hoxb8 در سلولهای ایمنی موجود در خون محیطی (که میتوانند نمایانگر وضعیت میکروگلیا در مغز باشند) را اندازهگیری کنیم، این امر میتواند به ابزارهای تشخیصی جدیدی منجر شود.
کاربرد بالقوه:
امروزه، تشخیص اضطراب عمدتاً مبتنی بر گزارشهای رفتاری بیمار است. در آینده، اندازهگیری میزان عدم تعادل بین زیرگروههای میکروگلیایی میتواند به تشخیص پیش از بروز اضطراب در افرادی که سابقه خانوادگی قوی دارند یا در معرض استرس شدید قرار گرفتهاند، کمک کند. این امر به مداخله زودتر، پیش از تثبیت مدارهای اضطراب، اجازه میدهد.
هدفگیری مولکولی: فراتر از SSRIها
داروهای رایج ضداضطراب (مانند مهارکنندههای بازجذب سروتونین انتخابی – SSRIها) بر نورونها تأثیر میگذارند، اما اغلب کارایی محدودی دارند و با عوارض جانبی قابل توجهی همراه هستند. رویکرد جدید، هدف قرار دادن مستقیم سلولهای میکروگلیا است.
هدفگیری ترمزها و گازها:
- تقویت $\text{MG}_{\text{Hoxb8+}}$: توسعه داروهایی که به طور انتخابی بیان ژن Hoxb8 را در میکروگلیاهای موجود تقویت کنند. این داروها میتوانند به عنوان “تقویتکنندههای آرامش” عمل کرده و به مغز کمک کنند تا پاسخهای استرس را به طور فعال سرکوب کند.
- مهار $\text{MG}_{\text{Hoxb8-}}$: طراحی مولکولهایی که فعالسازی بیش از حد $\text{MG}_{\text{Hoxb8-}}$ را در پاسخ به استرس مهار کنند، بدون آنکه قابلیت دفاعی کلی آنها در برابر عفونتها از بین برود (دقت هدفگیری بسیار حیاتی است).
این رویکرد، درمانهایی را نوید میدهد که نه تنها علائم اضطراب را پوشش میدهند، بلکه مستقیماً مکانیسمهای پایه تنظیمکننده مغز را اصلاح میکنند. این یک تغییر پارادایم از درمان علائم به درمان علت زمینهای است.
آینده درمان: عصر نوین داروهای ایمنی-عصبی (Neuro-Immunotherapeutics)
مسیر پیش رو درمانی، ترکیبی از ژندرمانی، نانوتکنولوژی و داروهای مولکولی هدفمند خواهد بود که بهطور اختصاصی برای تعامل با میکروگلیا طراحی شدهاند.
استفاده از حاملهای هدفمند نانوذرات
یکی از بزرگترین چالشها در درمانهای متمرکز بر میکروگلیا، عبور دادن دارو از سد خونی-مغزی (Blood-Brain Barrier – BBB) و رساندن آن به سلولهای هدف در عمق مغز است.
نانوتکنولوژیها، بهویژه لیپوزومها یا نانوذرات پلیمری اصلاحشده، راهکار ایدهآلی ارائه میدهند. دانشمندان در حال توسعه نانوحاملهایی هستند که میتوانند سطوح خاصی بر روی میکروگلیاها را شناسایی کرده و محموله درمانی (مانند siRNA برای خاموش کردن ژنهای التهابی یا مولکولهای تقویتکننده Hoxb8) را دقیقاً در محل آزاد کنند.
ژندرمانی برای تنظیم دائمی
در بلندمدت، ژندرمانی میتواند به عنوان یک راهحل پایدار عمل کند. اگر عدم تعادل میکروگلیایی ناشی از نقص ژنتیکی اولیه باشد، میتوان با استفاده از ناقلهای ویروسی (مانند AAVها) که به طور خاص میکروگلیاها را هدف قرار میدهند، ژن Hoxb8 را به سلولهایی که بیان کافی ندارند، بازگرداند. این امر پتانسیل ایجاد یک تنظیمکننده داخلی و دائمی برای اضطراب را فراهم میآورد.
نقش میکروگلیا در اضطراب مرتبط با سن و بیماریهای تخریبکننده عصبی
میکروگلیاها نه تنها در اضطراب حاد، بلکه در تنظیم اضطراب مرتبط با پیری و بیماریهای تحلیلبرنده عصبی (مانند آلزایمر یا پارکینسون) نیز نقش دارند. با افزایش سن، عملکرد میکروگلیاها دچار اختلال میشود؛ آنها به سمت وضعیت مزمن التهابی متمایل میشوند که میتواند زمینهساز افزایش اضطراب و زوال شناختی باشد.
درک چگونگی حفظ وضعیت Hoxb8 مثبت در طول عمر، میتواند به ابزارهایی برای حفظ سلامت روان در دوران پیری منجر شود. اگر $\text{MG}_{\text{Hoxb8+}}$ بتوانند وظایف حمایتی خود را حفظ کنند، احتمال بروز “اضطراب پیری” (Geriatric Anxiety) کاهش مییابد.
جمعبندی: افقهای جدید در مبارزه با اضطراب
کشف نقش دو زیرگروه متضاد میکروگلیا، $\text{MG}{\text{Hoxb8+}}$ (ترمز) و $\text{MG}{\text{Hoxb8-}}$ (گاز)، نه تنها یک پیشرفت فنی در تکنیکهای تکسلولی است، بلکه یک تغییر بنیادی در درک ما از پاتوفیزیولوژی اضطراب است.
اضطراب دیگر صرفاً یک اختلال مدارهای الکتریکی (نورونی) نیست، بلکه یک ناهنجاری در سیستم مدیریت ایمنی-عصبی مغز است. این دیدگاه جدید ما را قادر میسازد تا به جای تمرکز صرف بر شیمی سیناپسی، بر تنظیمکنندههای سلولی تمرکز کنیم که فعالیت این شبکهها را دیکته میکنند.
آینده تحقیقات روانپزشکی به شدت وابسته به توانایی ما در نقشهبرداری دقیقتر از این سلولهای نگهبان خواهد بود. هدف نهایی، طراحی نسل بعدی درمانهایی است که بتوانند توازن ظریف بین هوشیاری (که توسط $\text{MG}{\text{Hoxb8-}}$ تنظیم میشود) و آرامش (توسط $\text{MG}{\text{Hoxb8+}}$ پشتیبانی میشود) را بازگردانند. این مسیر، امیدواری تازهای را برای میلیونها فردی که با سایه سنگین اضطراب دست و پنجه نرم میکنند، به ارمغان میآورد و مرزهای علوم اعصاب را به سطوح جدیدی سوق میدهد.
۲۰ سؤال متداول درباره نقش میکروگلیا در اضطراب (FAQ)
این بخش به صورت خلاصه و سئوپسند، به رایجترین پرسشها درباره نقش سلولهای ایمنی مغز در اضطراب پاسخ میدهد.
۱. میکروگلیا چیست؟
میکروگلیاها، سلولهای ایمنی ساکن و مقیم سیستم عصبی مرکزی (مغز و نخاع) هستند که وظیفه نظارت، پاکسازی و تنظیم محیط مغز را بر عهده دارند.
۲. آیا اضطراب فقط مربوط به نورونها است؟
خیر. تحقیقات جدید نشان میدهند که سلولهای پشتیبان مغز، بهویژه میکروگلیا، نقش فعالی در تنظیم پاسخهای ترس و اضطراب دارند.
۳. چرا میکروگلیاها در تنظیم اضطراب مهم هستند؟
آنها با هرس سیناپسی و تعدیل سطح التهاب در نواحی کلیدی مانند آمیگدال، مستقیماً بر میزان حساسیت مغز به محرکهای استرسزا تأثیر میگذارند.
۴. تفاوت اصلی بین دو زیرگروه میکروگلیا چیست؟
این دو زیرگروه بر اساس بیان ژن Hoxb8 از هم متمایز میشوند: یک گروه مهارکننده اضطراب (Hoxb8+) و یک گروه تقویتکننده اضطراب (Hoxb8-).
۵. منظور از $\text{MG}_{\text{Hoxb8+}}$ چیست؟
این زیرگروه از میکروگلیاها بیانگر ژن Hoxb8 هستند و نقش اصلی آنها به عنوان “ترمز اضطراب” و حفظ تعادل عصبی است.
۶. نقش $\text{MG}_{\text{Hoxb8-}}$ در اضطراب چیست؟
این سلولها، هنگام فعالسازی بیش از حد (معمولاً در استرس مزمن)، باعث التهاب عصبی شده و حساسیت به ترس را افزایش میدهند و مانند “پدال گاز اضطراب” عمل میکنند.
۷. ژن Hoxb8 چه نقشی در این فرآیند دارد؟
Hoxb8 یک عامل رونویسی است که بیان آن مشخصه جمعیتی است که به حفظ ثبات و مهار پاسخهای اغراقآمیز اضطرابی کمک میکند.
۸. چگونه محققان این دو گروه را شناسایی کردند؟
از تکنیک پیشرفته توالییابی RNA تکسلولی (scRNA-seq) استفاده شد تا پروفایلهای مولکولی هر سلول به صورت جداگانه بررسی شود.
۹. آیا استرس مزمن میتواند وضعیت میکروگلیاها را تغییر دهد؟
بله، استرس مزمن میتواند باعث شود میکروگلیاهای مهارکننده (Hoxb8+) به زیرگروه التهابی (Hoxb8-) تبدیل شوند و تعادل را بر هم زنند.
۱۰. این کشف چه تأثیری بر درمانهای فعلی اضطراب (مانند SSRIها) دارد؟
این کشف نشان میدهد که باید علاوه بر نورونها، بر روی سلولهای ایمنی مغز نیز تمرکز کرد تا درمانها ریشهایتر و مؤثرتر باشند.
۱۱. آیا میتوان میکروگلیاها را دارویی هدف قرار داد؟
بله، هدفگیری مستقیم مسیرهای مولکولی مانند Hoxb8 در میکروگلیاها، آینده درمان اضطراب است.
۱۲. آیا میتوان با تقویت $\text{MG}_{\text{Hoxb8+}}$ اضطراب را کاهش داد؟
این یک استراتژی درمانی محتمل است؛ یعنی توسعه داروهایی که بیان Hoxb8 را افزایش داده و فعالیت “ترمز اضطراب” را تقویت کنند.
۱۳. چه کسانی بیشتر در معرض ناهنجاری میکروگلیایی هستند؟
افرادی که سابقه مواجهه طولانیمدت با استرسهای محیطی یا التهابهای مزمن (در هر نقطه از بدن) داشتهاند، در معرض خطر بیشتری برای فعال شدن غیرطبیعی $\text{MG}_{\text{Hoxb8-}}$ هستند.
۱۴. آیا این یافتهها در انسان نیز تأیید شدهاند؟
تحقیقات اولیه عمدتاً در مدلهای حیوانی انجام شده، اما شواهد غیرمستقیم قوی از طریق نشانگرهای التهابی در بیماران انسانی وجود دارد که این فرضیهها را تأیید میکند.
۱۵. میکروگلیا در تنظیم یادگیری ترس چه نقشی دارد؟
میکروگلیاها با تعدیل قدرت سیناپسی در مسیرهای مرتبط با ترس (مانند آمیگدال)، میزان یادگیری و تثبیت پاسخهای اضطرابی را کنترل میکنند.
۱۶. آیا مشکلات میکروگلیا فقط به اضطراب مربوط است؟
خیر. اختلال در عملکرد میکروگلیا با طیف وسیعی از اختلالات عصبی و روانپزشکی، از جمله افسردگی، اوتیسم و بیماری آلزایمر، مرتبط است.
۱۷. سد خونی-مغزی (BBB) چگونه بر درمان میکروگلیا تأثیر میگذارد؟
BBB دسترسی دارو به مغز را محدود میکند؛ بنابراین، نانوتکنولوژی برای رساندن هدفمند داروهای ضد-اضطراب میکروگلیایی ضروری است.
۱۸. سلولهای ایمنی مغز به طور عمومی چه وظایفی دارند؟
آنها مانند جراحان و پرستاران مغز عمل میکنند: نظارت بر محیط شیمیایی، از بین بردن سلولهای مرده، و تعدیل اتصالات عصبی.
۱۹. کدام نواحی مغز بیشترین تأثیرپذیری را از این میکروگلیاها دارند؟
قشر پیشپیشانی (PFC) و آمیگدال (Amygdala) که مراکز اصلی کنترل و پردازش ترس هستند، بیشترین تعامل را با این زیرگروهها دارند.
۲۰. آینده این پژوهشها به چه سمتی میرود؟
توسعه داروهای ایمنی-عصبی (Neuro-Immunotherapeutics) اختصاصی برای تنظیم تعادل بین $\text{MG}{\text{Hoxb8+}}$ و $\text{MG}{\text{Hoxb8-}}$ برای درمان مؤثر اضطراب و سایر اختلالات خلقی.